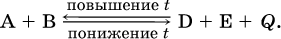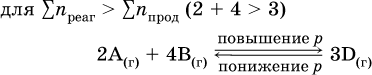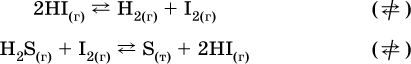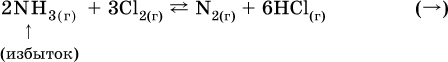Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
При воздействии на равновесную систему химическое равновесие смещается в сторону, противодействующую этому воздействию.Содержание книги
Поиск на нашем сайте
Рассмотрим подробнее влияние таких факторов, как температура, давление, концентрация, на смещение равновесия. 1. Температура. Повышение температуры смещает равновесие обратимой реакции в сторону процесса, идущего с поглощением теплоты (эндотермическое направление), а понижение температуры – в сторону процесса, идущего с выделением теплоты (экзотермическое направление). Для экзотермической реакции:
Для эндотермической реакции:
Значение Кс обязательно изменится при повышении и понижении температуры, так как значения констант скорости k прямой (→) и обратной (←) реакций по‑разному зависят от температуры, ведь это реакции между разными реагентами (соответственно А и В или D и Е). Следовательно, константа равновесия – функция температуры:
Kc = ƒ (t)
Примеры: а) повышение температуры (нагревание):
б) понижение температуры (охлаждение):
2. Давление. Изменение давления оказывает влияние только на те системы, где хотя бы одно вещество находится в газообразном состоянии (твердые и жидкие вещества не учитываются, так как их собственный объем весьма мал по сравнению с объемом газов и паров). Увеличение давления в обратимой реакции смещает равновесие с сторону процесса, идущего с уменьшением количества газообразных веществ, т. е. с уменьшением объема, а уменьшение давления – в сторону увеличения количества газообразных веществ, т. е. с увеличением объема: а)
б)
При Σnреаг = Σnпрод изменение не вызовет смещения равновесия. Примеры гомогенных реакций: а) увеличение давления (сжатие):
б) уменьшение давления (расширение):
Примеры гетерогенных реакций (коэффициенты перед формулами конденсированных веществ не учитываются): а) увеличение давления (сжатие):
б) уменьшение давления (расширение):
В реакциях с равными количествами газообразных реагентов и продуктов (здесь 2 = 2 в обоих примерах):
сдвиг равновесия наблюдаться не будет. 3. Концентрация. При увеличении концентрации одного из газообразных веществ (реагента или продукта), находящегося в равновесной системе, равновесие смещается в сторону расхода данного вещества. При уменьшении концентрации этого вещества равновесие смещается в сторону образования данного вещества. Изменение содержания твердых и жидких веществ не влияет на состояние равновесия.
Для некоторой реакции:
Смещение равновесия вправо можно было вызвать добавлением избытка реагента А (вместо В), а смещение влево возможно только избытком продукта D (другой продукт – твердое вещество). Этот вывод следует непосредственно из равновесного закона действующих масс:
При добавлении в систему газа D равновесие сместится влево т. е. при протекании обратной реакции так увеличится содержание газов А и В, что соотношение концентраций останется постоянным и равным К с. Отметим еще раз, что добавление конденсированного вещества (здесь твердого Е) не повлияет на состояние равновесия (сдвиг равновесия добавлением Е невозможен). Примеры: а) при добавлении аммиака равновесие сместится вправо:
б) при добавлении водорода равновесие сместится влево:
Примеры заданий части А
1. Гетерогенные реакции – это 1) Н2 + I2(г) → HI 2) Fe2(SO4)3(т) → Fe2O3(T) + SO3 3) Zn + H2SO4 → ZnSO4 + H2↑ 4) CO + H2 → CO + H2O (nap) 2. При взаимодействии H2 с Cl2, Br2 и I2 в сосудах равного объема через 27 с образуется по 0,04 моль продуктов. Скорость реакции 1) выше для I2 2) выше для Cl2 3) одинакова 4) выше для Br2 3. Для гомогенной реакции А + В →… при одновременном увеличении молярной концентрации исходных веществ в 3 раза скорость реакции возрастет 1) в 2 раза 2) в 3 раза 3) в 6 раз 4) в 9 раз 4–6. Скорость реакции 4. 2CuО(т) + СО →… 5. 2FeO(т) + С(т) →… 6. N2 + 2С(т) + Н2 →… при V = const и увеличении количества веществ в 4 раза изменится так: 1) возрастет в 4 раза 2) возрастет в 8 раз 3) возрастет в 16 раз 4) не изменится 7–8. Равновесие смещается вправо (→) при 7. нагревании 8. охлаждении реакционных систем 1) 2СО + O2 2СO2 + Q 2) 2HI + Н2 + I2 – Q 3) N2 + O2 2NO – Q 4) 2Н2 + O2 2Н2O + Q 9. Равновесие реакции этерификации СН3СООН + С2Н5ОН СН3СООС2Н5 + Н2O + Q можно сдвинуть вправо (→) 1) добавлением серной кислоты 2) добавлением едкого натра 3) нагреванием 4) добавлением воды 10. Равновесие в гетерогенной реакции СаО(ст) + СО2 СаСO3(т) + Q сместится влево (←) при 1) добавлении СаО 2) добавлении СаСO3
3) сжатии 4) нагревании 11. Выход продукта в реакции CaS(т) + 2O2 CaSO4(т) + Q можно увеличить 1) добавлением CaS 2) нагреванием 3) введением катализатора 4) повышением давления 12. Доменный процесс Fe2O3 + ЗСО 2Fe + ЗСO2 сопровождается экзо ‑эффектом, следовательно, при охлаждении выход продуктов 1) увеличивается 2) уменьшается 3) не изменяется 4) не знаю
|
||||||
|
Последнее изменение этой страницы: 2016-09-18; просмотров: 130; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.188.174 (0.008 с.) |