
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы. Концентрации растворовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пример 1. В водном растворе хлорида бария объемом 0,800 л с плотностью 1,20
Решение. а) Массовая доля (w), выраженная в процентах, показывает, сколько граммов растворенного вещества содержится в 100 г раствора.
где m – масса ВаСl2; mp – масса раствора, г (mp = V·ρ = 800·1,2 = 960 г); V – объем раствора, мл (0,8 л = 800 мл); ρ – плотность раствора,
б) Молярная концентрация показывает число молей растворенного вещества в 1 л раствора и выражается в
в 800 мл раствора содержится 192 г ВаСl2 в 1000 мл раствора содержится x г ВаСl2
Молярная масса ВаСl2 равна (М(ВаСl2) = 137 + (35,5·2)) = 208
Молярная концентрация
Пример 2. Какой объем раствора (1) KOH с массовой долей ω1 = 34,9% (ρ1 = 1,34
Решение. К решению нужно подойти, исходя из неизменности в исходном и полученном растворах: 1) массы КОН, г; 2) количества КОН, моль. Более рационален второй подход.
Количество КОН
где m – масса КОН; М – молярная масса КОН.
Учитывая, что m = V2·ρ2·ω2, получаем
Молярная концентрация
(обратите внимание на соответствие размерностей величин).
Для исходного раствора
Отсюда объем исходного раствора равен
Задания
103. Вычислите молярную концентрацию раствора хлорида натрия (ρ = 1,148 104. Какой объем раствора хлороводородной кислоты (ρ = 1,100 105. Смешали 10 мл раствора азотной кислоты (ρ = 1,056 106-110. Водный раствор содержит массу m вещества А в объеме V. Плотность раствора ρ. Вычислите массовую долю (в %), молярную долю, молярную концентрацию, молярную концентрацию эквивалентов.
111-115. Какой объем раствора вещества A с массовой долей ω1, (плотность ρ1) следует взять для приготовления объема V2 раствора с массовой долей ω2 (плотность ρ2)? Чему равна молярная концентрация полученного раствора?
116-120. К раствору вещества А объемом Vl с молярной концентрацией c1 добавили воду объемом
Электрохимические системы.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 691; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.34.148 (0.007 с.) |

 содержится BaCl2 массой 192 г. Вычислите массовую долю и молярную концентрацию.
содержится BaCl2 массой 192 г. Вычислите массовую долю и молярную концентрацию. = 0,2 или 20%,
= 0,2 или 20%, .
. . Массу ВаСl2 в 1 л раствора находят из соотношения
. Массу ВаСl2 в 1 л раствора находят из соотношения = 240 г BaCl2
= 240 г BaCl2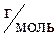 , следовательно, число молей ВаСl2, содержащихся в 1 л раствора, равно
, следовательно, число молей ВаСl2, содержащихся в 1 л раствора, равно = 1,15 моль.
= 1,15 моль.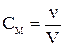 = 1,15
= 1,15 
 = 0,539 моль.
= 0,539 моль. = 2,16
= 2,16  ,
, = 64,7 мл.
= 64,7 мл. ) с массовой долей NaCl – 20%.
) с массовой долей NaCl – 20%. . Плотность полученного раствора ρ2. Чему равны молярная концентрация полученного раствора c2 и массовая доля ω2?
. Плотность полученного раствора ρ2. Чему равны молярная концентрация полученного раствора c2 и массовая доля ω2?


