
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические источники электричества.Содержание книги
Поиск на нашем сайте
Электродные потенциалы. Гальванические элементы
Пример 1. Напишите уравнения анодного и катодного процессов, суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе, схема которого:
Ni │ NiSO4 ║ CoSO4 │ Co (0,001 M) (1 M)
(В скобках приведены молярные концентрации растворов соответствующих солей). Вычислите величину электродвижущей силы (ЭДС) гальванического элемента.
Решение. Рассчитаем величины электродных потенциалов по уравнению Нернста:
где
На электроде, имеющем меньший потенциал, происходит отдача электронов, т. е. окисление. Этот электрод называется анодом. Поскольку На электроде, имеющем больший потенциал, происходит принятие электронов, т. е. восстановление. Этот электрод называется катодом. Им является кобальтовый электрод. Процессы, протекающие в гальваническом элементе:
Анод Ni – 2 Катод Co2+ + 2 Ионно-молекулярное уравнение: Ni + Co2+ = Ni2+ + Co Молекулярное уравнение: Ni + CoSO4 = NiSO4 + Co
ЭДС = E(к) – E(а) = –0,28 – (–0,34) = 0,06 В.
Пример 2. В каком направлении может самопроизвольно протекать реакция
2Bi + 3CdCl2
Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1
Решение. Окислительно-восстановительная реакция возможна, если потенциал предполагаемого окислителя больше потенциала предполагаемого восстановителя: Eокисл > Eвосст. Для прямой реакции
окислителем должен являться ион Cd2+, а восстановителем – металлический висмут Для обратной реакции окислителем оказывается ион Bi3+, а восстановителем – металлический кадмий
2BiCl3 + 3Cd = 2Bi + 3CdCl2
В гальваническом элементе на аноде (Cd) протекает процесс окисления кадмия, а на катоде (Bi) – процесс восстановления ионов Bi3+:
Анод Cd – 2 Катод Bi3+ + 3 2Bi3+ + 3Cd = 2Bi + 3Cd2+
Схема гальванического элемента:
(А) Cd │ CdCl2 ║ BiCl3 │ Bi (К)
ЭДС = E(к) – E(а) =
Задания
141-150. Напишите уравнения анодного и катодного процессов, Суммарные ионно-молекулярное и молекулярное уравнения этих процессов, протекающих в гальваническом элементе. Вычислите величину электродвижущей силы (ЭДС) гальванического элемента при указанных молярных концентрациях растворов соответствующих солей.
151-160. Дайте обоснованный ответ, в каком направлении может самопроизвольно протекать заданная реакция? Составьте схему гальванического элемента, в котором протекает эта реакция. Напишите уравнения анодного и катодного процессов, а также суммарное ионно-молекулярное уравнение. Определите ЭДС при концентрациях потенциалообразующих ионов в анодном и катодном пространстве, равных 1
Электролиз
Пример 1. Составьте уравнения электродных процессов, протекающих при электролизе водного раствора Bi2(SO4)3 в электролизерах: а) с угольными электродами; б) с висмутовыми электродами. Для каждого варианта вычислите массы веществ, полученных (или растворенных) на электродах, если через электролизеры пропущен ток силой 10,0 А в течение 1 ч 10 мин. Для газообразных веществ определите их объем при н.у.
Решение. а) На катоде в первую очередь протекает восстановление наиболее сильных окислителей, характеризующихся бόльшим потенциалом. К отрицательно заряженному катоду движется катионы Bi3+, которые могут восстанавливаться до металлического висмута (
Bi3+ + 3
К положительно заряженному аноду движутся анионы
2H2O – 4
По законам Фарадея масса восстановленного на катоде висмута:
где I – сила тока, А; τ – продолжительность электролиза, с; F – константа Фарадея, 96 500 Кл.
Масса выделившегося на аноде кислорода:
где
Объем, занимаемый газом при н.у., определяется по формуле:
где n – количество газа, моль; m – масса газа, г; M – молярная масса газа, V0 = 22,4 л – объем одного моль газа при н.у.
Для кислорода
б) На висмутовом аноде кроме окисления воды возможно окисление висмута – материала анода. На аноде протекает, в первую очередь, окисление наиболее сильных восстановителей, характеризующихся меньшим потенциалом. Поскольку
Bi – 3
На катоде, как и в варианте (а), восстанавливается висмут:
Bi3+ + 3
Массы осажденного на катоде и растворенного на аноде висмута одинаковы и определяются уравнением (1): на катоде из раствора восстановилось 30,3 г висмута и столько же висмута растворилось на аноде.
Пример 2. При электролизе водных растворов AgNO3 и NiSO4 в двух электролизерах, соединенных последовательно, на катодах выделилось соответственно серебро массой 5,39 г и никель массой 1,39 г. Определите выход по току никеля, если выход по току серебра 100%. Какова продолжительность электролиза при силе тока 5,00 А?
Решение. Если на электроде возможно одновременно протекание нескольких процессов, то используют понятие выхода по току. Выходом по току i-го вещества (Bi) называется доля общего количества электричества в процентах, которая расходуется на окисление или восстановление i-го вещества при электролизе
где Q = I·τ – общее количество прошедшего электричества; Qi – количество электричества, израсходованное на окисление или восстановление i-го вещества; mi – масса i-го вещества, окисленного или восстановленного на электроде; mi(τ) – то же, теоретически рассчитанное из предположения 100%-ного выхода по току.
Из законов Фарадея по массе выделившегося серебра при 100%-ном выходе по току определим продолжительность электролиза τ:
Рассчитаем массу никеля, которая выделилась бы при 100%-ном выходе по току
Выход по току никеля
Пример 3. В течение какого времени следует проводить электролиз при силе тока 8,00А для выделения на катоде всей меди, содержащейся в 250 мл 0,100 М раствора CuSO4?
Решение. Из законов Фарадея
или
где nэк(Cu) – количество моль эквивалентов меди. Количество моль меди в растворе
nCu = cV = 0,100·0,250 = 0,0250 моль,
где c – молярная концентрация CuSO4, V – объем раствора, л.
Поскольку эквивалент меди ЭCu = ½ Cu, то nэк(Cu) = 2nCu = = 2·0,0250 = 0,0500 моль. Подставим значение nэк(Cu) в уравнение (2):
Задания
161-168. Электролиз водного раствора вещества X проводили с угольными электродами катодного и анодного процессов. Вычислите массы веществ, выделившихся на катоде и на аноде. Определите объем выделившихся газообразных веществ (н.у.).
169-175. Электролиз водного раствора вещества X проводили с анодом из материала Y при силе тока I. Составьте уравнения электродных процессов. Определите, сколько потребуется времени для окисления на аноде массы mA соответствующего вещества. Составьте уравнения электродных процессов с угольным анодом.
176. При электролизе водных растворов KI и CuSO4 в двух электролизерах, соединенных последовательно, масса одного из катодов увеличилась на 15,7 г. Какое количество электричества было пропущено через электролизеры? Составьте уравнения катодных и анодных процессов в каждом из электролизеров, если электроды угольные. 177. Через два соединенных последовательно электролизера, содержащих, соответственно, водные растворы Na2SO4 и AgNO3, пропускали ток силой 10,0 А в течение 1 ч 40 мин. На какую величину увеличилась масса одного из электродов? Составьте уравнения всех катодных и анодных процессов, если электроды угольные. 178. Составьте уравнения процессов, протекающих на угольных электродах при электролизе: а) водного раствора MgCl2; б) расплава MgCl2. Вычислите массу веществ, выделяющихся на электродах в том и другом случаях, если через раствор и расплав пропустили ток силой 20,0 А в течение 1 ч 20 мин. Определите объем выделяющихся газов (н.у.). 179. Составьте электронные уравнения процессов, происходящих на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом; с растворимым серебряным анодом. Вычислите массу серебра и объем кислорода, выделившихся на электродах при электролизе водного раствора AgNO3 с нерастворимым анодом, если время 180. Составьте электронные уравнения процессов, происходящих на электродах при электролизе растворов MgSO4 и ZnCl2. Вычислите силу тока при электролизе раствора MgSO4 в течение 1 ч 40 мин, если на катоды выделилось 1,4 л водорода (н.у.). Коррозия и защита металлов
Пример 1. Возможна ли коррозия сплава, состоящего из мелкодисперсных кристаллов висмута и свинца: а) в аэрируемой воде; б) в изолированном от воздуха сосуде с водой? Для среды, в которой коррозия возможна, составьте схему микрогальванических элементов, возникающих в процессе коррозии. Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии.
Решение. Как любой окислительно-восстановительный процесс, коррозия возможна, если потенциал окислителя больше потенциала восстановителя (Eокисл > Eвосст). Отсюда следует, что в первую очередь будет окисляться, т.е. корродировать, металл, имеющий меньший электродный потенциал. Таким металлом в данном примере является свинец ( а) В аэрируемой воде из двух возможных окислителей – иона водорода воды H+ и растворенного в воде кислорода O2 – более сильным окислителем является кислород, так как его потенциал больше (в нейтральной среде Схема гальванического элемента: Pb | O2; H2O | Bi. Анодом является свинец, катодом – висмут. Протекают процессы:
Анод Pb – 2 Катод O2 + 4 2Pb + O2 + 2H2O = 2Pb(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид свинца Pb(OH)2.
б) В отсутствие кислорода единственным окислителем могли бы быть ионы водорода из воды. Но поскольку Eокисл = –0,41 В < Eвосст = –0,13 В, коррозия невозможна.
Пример 2. Какие процессы будут протекать при коррозии бериллия и меди, находящихся в контакте? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в следующих средах: а) во влажном воздухе; б) в растворе гидроксида натрия; в) в растворе хлороводородной кислоты.
Решение. Из контактирующих металлов более активным восстановителем является бериллий, так как
а) Во влажном воздухе окислителем является кислород. Коррозия возможна, так как его потенциал значительно больше потенциала бериллия. Бериллий будет являться анодом и окисляться, а медь – катодом, где будет восстанавливаться кислород:
Анод Be – 2 Катод O2 + 4 2Be + O2 + 2H2O = 2Be(OH)2 ↓
Продуктом коррозии является труднорастворимый гидроксид бериллия.
б) Поскольку гидроксид бериллия амфотерен, в щелочном растворе процесс анодного окисления бериллия заканчивается образованием гидроксокомплекса:
Анод Be – 2
Несмотря на то, что потенциал кислорода больше, чем иона водорода воды, доступ кислорода к поверхности катода (медь) ограничен из-за малой его растворимости и медленной диффузии. Поэтому в щелочном растворе (pH 14) при условии
Катод 2H2O + 2
Результирующее уравнение процесса коррозии получим, суммируя уравнения анодного и катодного процессов:
Be + 2H2O + 2OH– = [Be(OH)4]2– + H2
или
Be + 2H2O + 2NaOH = Na2[Be(OH)4] + H2
в) По тем же кинетическим причинам, что и в предыдущем случае, окислителем является ион водорода H+. Уравнения процессов:
Анод Be – 2 Катод H2 + 2 Be + 2H2 = Be2+ + H2
или
Be + 2HCl = BeCl2 + H2
Задания
181-192. Какие коррозионные процессы могут протекать при контакте двух металлов? Составьте уравнения анодного и катодного процессов и результирующее (суммарное) уравнение процесса коррозии в заданных условиях. Если коррозия невозможна, то объясните, почему?
193. Приведите пример катодного покрытия для никеля. Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих в аэрируемом водном растворе и в солянокислой среде при частичном нарушении такого покрытия. 194. Приведите пример анодного покрытия для кадмия. Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих в сернокислом растворе и во влажном воздухе, при частичном нарушении такого покрытия. 195. Какие металлы можно использовать для протекторной защиты железа? Для одного из примеров напишите уравнения анодного, катодного и суммарного процессов коррозии в аэрируемом водном растворе и в сернокислой среде. 196. В чем сущность катодной защиты от коррозии? Какие процессы протекают на электродах при катодной защите стального трубопровода, проложенного во влажном грунте? 197. К какому типу покрытий относится лужение (покрытие оловом) меди? Напишите уравнения анодного, катодного и суммарного процессов коррозии, протекающих во влажном воздухе и в сернокислой среде при частичном нарушении этого покрытия. 198-200. Возможна ли в средах (а) и (б) коррозия сплава, представляющего собой смесь мелкодисперсных кристаллов металлов X и Y? В случае возможности коррозии составьте схему микрогальванических элементов, возникающих в процессе коррозии. Напишите уравнения анодного и катодного процессов и суммарное уравнение процесса коррозии. Если коррозия невозможна, то объясните, почему?
Варианты контрольных заданий
Приложения
1. Стандартные теплоты (энтальпии) образования некоторых веществ при 298К (25ºС)
2. Стандартные энтропии при 298К (25ºС)
3. Стандартная энергия Гиббса образования некоторых веществ при 298К (25ºС)
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 386; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.220.134.161 (0.013 с.) |

 ,
, – стандартный электродный потенциал (см. в Приложении: табл. 6;
– стандартный электродный потенциал (см. в Приложении: табл. 6;  = –0,25 В;
= –0,25 В; 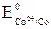 = –0,28 В).
= –0,28 В). = –0,25 +
= –0,25 + 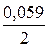 ·(–3) = –0,34 В.
·(–3) = –0,34 В. = –0,28 +
= –0,28 +  <
< 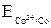 , анодом является никелевый электрод.
, анодом является никелевый электрод. = Ni2+
= Ni2+ 2BiCl3 + 3Cd
2BiCl3 + 3Cd .
.

 . Однако соотношение их электродных потенциалов:
. Однако соотношение их электродных потенциалов: 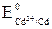 = –0,40 В <
= –0,40 В <  = +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.
= +0,22 В, т.е. электродный потенциал предполагаемого окислителя оказывается меньше потенциала предполагаемого восстановителя: Eокисл < Eвосст. Прямая реакция невозможна.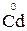 , т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции
, т.е. Eокисл > Eвосст. Возможно самопроизвольное протекание обратной реакции = Cd2+ │ 3
= Cd2+ │ 3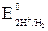 = 0,00 В при pH 0;
= 0,00 В при pH 0;  и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода:
и полярные молекулы воды. В сульфат-ионе сера находится в высшей степени окисления (+6), поэтому дальнейшее окисление серы невозможно. В данных условиях протекает единственно возможный процесс – окисление воды до кислорода: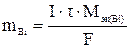 , (1)
, (1)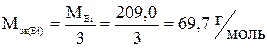 ;
;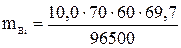 = 30,3 г.
= 30,3 г. = 3,48 г,
= 3,48 г, .
. ,
,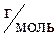 ;
;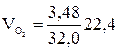 = 2,44 л.
= 2,44 л. = +1,23В, то окисляться будет материал анода:
= +1,23В, то окисляться будет материал анода: ,
, = 964 с = 16 мин 4 с.
= 964 с = 16 мин 4 с. = 1,47 г.
= 1,47 г.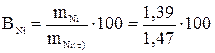 = 94,6%.
= 94,6%. ,
, , (2)
, (2) = 603 c = 10 мин 3 с.
= 603 c = 10 мин 3 с.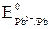 = –0,13 В <
= –0,13 В <  = +0,81 В >
= +0,81 В > 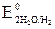 = –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В.
= –0,41 В). Коррозия возможна, так как Eокисл = +0,81 В > Eвосст = –0,13 В. = Pb2+ │ 2
= Pb2+ │ 2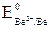 = –1,85 В <
= –1,85 В < 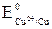 = +0,34 В, поэтому, в первую очередь, корродирует бериллий.
= +0,34 В, поэтому, в первую очередь, корродирует бериллий.
 некоторых веществ
некоторых веществ




