
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окислительно-восстановительные реакции.Содержание книги
Поиск на нашем сайте
Пример 1. Исходя из степеней окисления хрома и селена, определите, какие из веществ (К2СrO4, Cr, Cr2O3, Na2Cr2O7, SeO3, Na2Se, Se) в процессе ОВР могут проявлять: а) только окислительные свойства; б) только восстановительные свойства; в) как окислительные, так и восстановительные свойства?
Решение. Только окислительные свойства могут проявлять вещества, содержащие атомы элемента в высшей степени окисления. Высшая степень окисления хрома (VI B-подгруппа, валентные электроны 3d54s1) и селена (VI A-подгруппа, валентные электроны 4s24p4) равна +6, так как атом каждого из этих элементов может отдать 6 электронов. Такая степень окисления имеется в K2CrO4, Na2Cr2O7, SeO3. Только восстановительные свойства могут проявлять вещества, содержащие атомы элемента в низшей степени окисления. До образования устойчивой электронной структуры 4s24p6 у атома селена не хватает двух электронов, которые он может принять, поэтому низшая степень окисления селена равна –2. Этому соответствует Na2Se. Металлы, к которым относится и хром, могут только отдавать электроны, но не могут их принимать. Поэтому низшая степень окисления хрома равна нулю, т. е. это металлический хром Cr0. В соединениях Пример 2. ОВР протекают по схемам: 1) FeSO4 + К2Cr2О7 + H2SO4 2) К2МnО4 + Н2О
Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на их основании расставьте коэффициенты в уравнениях реакций.
Решение. 1) В схеме реакции расставим изменяющиеся степени окисления:
Определим характер процессов:
В данной реакции окислитель и восстановитель различные вещества. Такие реакции называются межмолекулярными. Составляем электронные уравнения:
(Коэффициенты удваиваем, так как в каждом моль K2Cr2O7, Cr2(SO4)3, Fe2(SO4)3 содержатся по два моль
Поскольку число электронов, отдаваемых восстановителем, должно равняться числу электронов, принимаемых окислителем, умножим электронные уравнения на соответствующие коэффициенты:
Подставляем эти коэффициенты в схему реакции 6FeSO4 + K2Cr2O7 + H2SO4
Находим подбором и расставляем остальные коэффициенты 6FeSO4 + K2Cr2O7 + 7H2SO4
Окончательная проверка правильности написания уравнения проводится по балансу атомов кислорода.
6·4 + 7 + 7·4 = 3·3·4 + 3·4 + 4 + 7, 59 = 59.
2) В результате аналогичных действий получим:
– процесс окисления;
– процесс восстановления. Здесь и окислителем, и восстановителем является атом одного и того же элемента в промежуточной степени окисления, содержащийся в одной и той же молекуле (
Задания 121-140. Окислительно-восстановительные реакции протекают по приведенным схемам. Для каждой реакции укажите: а) окислитель и восстановитель; б) какое вещество окисляется, какое вещество восстанавливается. Составьте электронные уравнения и на основании их расставьте коэффициенты в уравнениях реакций.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-15; просмотров: 331; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.209.178 (0.007 с.) |

 , Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства.
, Se0 степени окисления хрома и селена промежуточные, поэтому возможны и окислительные, и восстановительные свойства. Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O
Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + H2O КMnО4 + МnО2 + КОН
КMnО4 + МnО2 + КОН




 – увеличение степени окисления; процесс окисления;
– увеличение степени окисления; процесс окисления;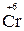
 – уменьшение степени окисления; процесс восстановления.
– уменьшение степени окисления; процесс восстановления. – восстановитель,
– восстановитель,  – окислитель.
– окислитель. – процесс окисления;
– процесс окисления; – процесс восстановления.
– процесс восстановления. соответственно).
соответственно).


 в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.
в К2МnО4). ОВР такого типа называются реакциями диспропорционирования.


