
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы выражения концентрации раствораСодержание книги
Поиск на нашем сайте
Концентрацией раствора называется содержание растворенного вещества в определенной массе или известном объеме раствора или растворителя. Пример 1. Вычислите: а) процентную (С %); б) молярную (СM); в) эквивалентную (Сн); г) моляльную (См) концентрации раствора Н3РО4, полученного при растворении 18 г кислоты в 282 см3 воды, если плотность его 1,031 г/см3. Чему равен титр T этого раствора? Решение: а) Массовая процентная концентрация показывает число граммов (единиц массы) вещества, содержащееся в 100 г (единиц массы) раствора. Так как массу 282 см3 воды можно принять равной 282 г, то масса полученного раствора 18 + 282 = 300 г и, следовательно,
100 – С %
б) мольно-объемная концентрация, или молярность, показывает число молей растворенного вещества, содержащихся в 1 л раствора. Масса 1 л раствора 1031 г. Массу кислоты в литре раствора находим из соотношения: 300 – 18
Молярность раствора получим делением числа граммов Н3РО4 в 1 л раствора на мольную массу Н3РО4 (97,99 г/моль): СМ = 61,86/97,99 = 0,63 М; в) эквивалентная концентрация, или нормальность, показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. Так как эквивалентная масса НзРО4 = М /3 = 97,99/3 =32,66 г/моль, то С Н = 61,86/32,66 = 1,89 н.; г) мольно-массовая концентрация, или моляльность, показывает число молей растворенного вещества, содержащихся в 100 г растворителя. Массу Н3РО4 в 1000 г растворителя находим из соотношения:
1000 – х
Отсюда С М = 63,83/97,99 =0,65 м. Титром раствора называется число граммов растворенного вещества в 1 см3 (мл) раствора. Так как в 1 л раствора содержится 61,86 г кислоты, то Т = 61,86/1000 = 0,06186 г/см3. Зная нормальность раствора и, эквивалентную массу (m Э) растворенного вещества, титр легко найти по формуле: Т = С Н m Э/1000. Пример 2. На нейтрализацию 50 см3 раствора кислоты израсходовано 25 см3 0,5 н. раствора щелочи. Чему равна нормальность кислоты? Решение. Так как вещества взаимодействуют между собой в эквивалентных соотношениях, то растворы равной нормальности реагируют в равных объемах. При разных нормальностях объемы растворов реагирующих веществ обратно пропорциональны их нормальностям, т.е.: V 1/ V 2 = C H2/ C H1 или V 1 C H1 = V 2 C H2. 50СН1 = 25 • 0,5, откуда СH1 = 25 • 0,5/50 = 0,25 н. Пример 3. К 1 л 10%-ного раствора КОН (пл. 1,092 г/см3) прибавили 0,5 л 5%-ного раствора КОН (пл. 1,045 г/см3). Объем смеси довели до 2 л. Вычислите молярную концентрацию полученного раствора. Решение. Масса одного литра 10%-ного раствора КОН 1092 г. В этом растворе содержится 1092 • 10/100 = 109,2 г КОН. Масса 0,5 л 5%-ного раствора 1045 • 0,5 = 522,5 г. В этом растворе содержится 522,5 • 5/100 =26,125 г КОН. В общем объеме полученного раствора (2 л) содержание КОН составляет 109,2 + 26,125 = 135,325 г. Отсюда молярность этого раствора СМ = 135,325/2 • 56,1 =1,2 М, где 56,1 г/моль – мольная масса КОН. Пример 4. Какой объем 96%-ной кислоты плотностью 1,84 г/см3 потребуется для приготовления 3 л 0,4 н. раствора? Решение. Эквивалентная масса H2SO4 = M/ 2= 98, 08/2 = 49,04 г/моль. Для приготовления 3 л 0,4 н. раствора требуется 49,04 • 0,4 • 3 = 58, 848 г H2SO4. Масса 1 см3 96%-ной кислоты 1,84 г. В этом растворе содержится 1,84 • 96/100 = 1,766 г Н2SО4. Следовательно, для приготовления 3 л 0,4 н. раствора надо взять 58,848: 1,766 = 33,32 см3 этой кислоты. Контрольные вопросы 141. Вычислите молярную и эквивалентную концентрации 20%-ного раствора хлорида кальция плотностью 1,178 г/см3. Ответ: 2,1 М; 4,2 н. 142.Чему равна нормальность 30%-ного раствора NaOH плотностью 1,328 г/см3? К 1 л этого раствора прибавили 5 л воды. Вычислите процентную концентрацию полученного раствора. Ответ: 9,96 н.; 6,3%. 143.К 3 л 10%-ного раствора НNО3 плотностью 1,054 г/см прибавили 5 л 144. Вычислите эквивалентную и меняльную концентрации 20,8%-ного раствора НNО3 плотностью 1,12 г/см3. Сколько граммов кислоты содержится в 4 л этого раствора? Ответ: 3,70 н.; 4,17 м; 931,8 г. 145.Вычислите молярную, эквивалентную и моляльную концентрации 146.Сколько и какого вещества останется в избытке, если к 75 см3 0,3 н. раствора H2SO4 прибавить 125 см3 0,2 н. раствора КОН? Ответ: 0,14 г КОН. 147.Для осаждения в виде АgСl всего серебра, содержащегося в 100 см3 раствора АgNО3, потребовалось 50 см3 0,2 н. раствора HCl. Какова нормальность раствора АgNО3? Какая масса AgCl выпала в осадок? Ответ: 0,1 н.; 1,433 г. 148.Какой объем 20,01%-ного раствора HCl (пл. 1,100 г/см3) требуется для приготовления 1 л 10,17%-ного раствора (пл. 1,050 г/см3)? Ответ: 485,38 см3. 149. Смешали 10 см3 10%-ного раствора HNO3 (пл. 1,056 г/см3) и 100 см3 30%-ного раствора HNO3 (пл. 1,184 г/см3). Вычислите процентную концентрацию полученного раствора. Ответ: 28,38%. 150. Какой объем 50%-ного раствора КОН (пл. 1,538 г/см3) требуется для приготовления 3 л 6%-ного раствора (пл. 1,048 г/см3)? Ответ: 245,5 см3. 151. Какой объем 10%-ного раствора карбоната натрий (пл. 1,105 г/см3) требуется для приготовления 5 л 2%-ного раствора (пл. 1,02 г/см3)? Ответ: 923,1 см3. 152. На нейтрализацию 31 см3 0,16 н. раствора щелочи требуется 217 см3 раствора H2SО4. Чему равны нормальность и титр раствора H2SО4? Ответ: 0,023 н.; 1.127х10-3 г/см3. 153. Какой объем 0,3 н. раствора кислоты требуется для нейтрализации раствора, содержащего 0,32 г NaOH в 40 см3? Ответ: 26,6 см3. 154. На нейтрализацию 1 л раствора, содержащего 1,4 г КОН, требуется 50 см3 раствора кислоты. Вычислите нормальность раствора кислоты. Ответ: 0,53 н. 155. Какая масса HNO3 содержалась в растворе, если на нейтрализацию его потребовалось 35 см3 0,4 н. раствора NaOH? Каков титр раствора NaOH? Ответ: 0,882 г, 0,016 г/см3. 156. Какую массу NаNО3 нужно растворить в 400 г воды, чтобы приготовить 20%-ный раствор? Ответ: 100 г. 157. Смешали 300 г 20%-ного раствора и 500 г 40%-ного раствора NaCl. Чему равна процентная концентрация полученного раствора? Ответ: 32,5%. 158. Смешали 247 г 62%-ного и 145 г 18%-ного раствора серной кислоты. Какова процентная концентрация полученного раствора? Ответ: 45,72%. 159. Из 700 г 60%-ной серной кислоты выпариванием удалили 200 г воды. Чему равна процентная концентрация оставшегося раствора? Ответ: 84%. 160. Из 10 кг 20%-ного раствора при охлаждении выделилось 400 г соли. Чему равна процентная концентрация охлажденного раствора? Ответ: 16,7%. Свойства растворов Пример 1. Вычислите температуры кристаллизации и кипения 2%-ного водного раствора глюкозы С6Н12О6. Решение. По закону Рауля понижение температуры кристаллизации и повышение температуры, кипения раствора (D t) no сравнению с температурами кристаллизации и кипения растворителя выражаются уравнением: где К – криоскопическая или эбуллиоскопическая константа. Для воды они соответственно равны 1,86 и 0,52°; m и М – соответственно масса растворенного вещества и его мольная масса; m 1 – масса растворителя. Понижение температуры кристаллизации 2%-ного раствора С6Н12О6 находим из формулы (1): Вода кристаллизуется при 0°С, следовательно, температуры кристаллизации раствора 0 – 0,21 = -0,21°С. Из формулы (1) находим и повышение температуры кипения 2%-ного раствора: Вода кипит при 100°С, следовательно, температура кипения этого растворе Пример 2. Раствор, содержащий 1,22 г бензойной кислоты C6H5COOH в 100 г сероуглерода, кипит при 46,529°С. Температура кипения сероуглерода 46,3°С, Вычислите эбуллиоскопическую константу сероуглерода. Решение. Повышение температуры кипения D t = 46,529 – 46,3 = 0,229°. Мольная масса бензойной кислоты 122 г/моль. Из формулы (1) находим эбуллиоскопическую константу: Пример 3. Раствор, содержащий 11,04 г глицерина в 800 г воды, кристаллизуется при -0,279°С. Вычислить мольную массу глицерина. Решение. Температура кристаллизации чистой воды 0°С, следовательно, понижение температуры кристаллизации D t = 0 – (-0,279) = 0,279°. Масса глицерина т (г), приходящаяся на 1000 г воды, Подставляя в уравнение данные, вычисляем мольную массу глицерина: Пример 4. Вычислите процентную концентрацию водного раствора мочевины (NH2)2CO, зная, что температура кристаллизации этого раствора равна -0,465°С. Решение. Температура кристаллизации чистой воды 0°С, следовательно, D t = 0 – (-0,465) = 0,465°. Мольная масса мочевины 60 г/моль. Находим массу m (г) растворенного вещества, приходящуюся на 100 г воды, из формулы (2): Общая масса раствора, содержащего 15 г мочевины, составляет 1000 + 15 = 1015 г. Процентное содержание мочевины в данном растворе находим из соотношения: в 1015 г раствора – 15 г вещества. " 100" " - х " " х = 1,48%. Контрольные вопросы 161.Раствор, содержащий 0,512 г неэлектролита в 100 г бензола, кристаллизуется при 5,296°С. Температура кристаллизации бензола 5,5°С. Криоскопическая константа 5,1°. Вычислите мольную массу растворенного вещества. Ответ: 128 г/моль. 162.Вычислите процентную концентрацию водного раствора сахара С12Н22О11, зная, что температура кристаллизации раствора -0,93°С. Криоскопическая константа воды 1,86°. Ответ: 14,6%. 163. Вычислите температуру кристаллизации раствора мочевины (NH2)2CO, содержащего 5 г мочевины в 150 г воды. Криоскопическая константа воды 1,86°. Ответ: -1,03° С. 164. Раствор, содержащий 3,04 г камфоры C10H16O в 100 г бензола, кипит при 80,714°С. Температура кипения бензола 80,2°С. Вычислите эбуллиоскопическую константу бензола. Ответ: 2,57°. 165. Вычислите процентную концентрацию водного раствора глицерина C3H5(ОН)3, зная, что этот раствор кипит при 100,39°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 6,45%. 166. Вычислите мольную массу неэлектролита, зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0,279°С. Криоскопическая константа воды 1,86°. Ответ: 60 г/моль. 167.Вычислите температуру кипения 5%-ного раствора нафталина С10Н8 в бензоле. Температура кипения бензола 80,2°С. Эбуллиоскопическая константа его 2,57°. Ответ: 81,25°С. 168.Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при –0,465° С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 342 г/моль. 169.Вычислите криоскопическую константу уксусной кислоты, зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15,718°С. Температура кристаллизации уксусной кислоты 16,65°С. Ответ: 3,9°. 170.При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0,81°. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2,57°. Ответ: 8. 171.Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна –0,558°С. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 442 г/моль. 172.Какую массу анилина C6H5NH2 следует растворить в 50 г этилового эфира, чтобы температура кипения раствора была выше температуры кипения этилового эфира на 0,53°. Эбуллиоскопическая константа этилового эфира 2,12°. Ответ: 1,16 г. 173.Вычислите температуру кристаллизации 2%-ного раствора этилового спирта C2H5OH. Криоскопическая константа воды 1,86°. Ответ: –0,82°С. 174.Сколько граммов мочевины (NN2)2СО следует растворить в 75 г воды, чтобы температура кристаллизации понизилась на 0,465°? Криоскопическая константа воды 1,86°. Ответ: 1,12 г. 175.Вычислите процентную концентрацию водного раствора глюкозы C6H12O6, зная, что этот раствор кипит при 100,26°С. Эбуллиоскопическая константа воды 0,52°. Ответ: 8,25%. 176.Сколько граммов фенола C6H5OH следует растворить в 125 г бензола; чтобы температура кристаллизации раствора была ниже температуры кристаллизации бензола на 1,7°? Криоскопическая константа бензола 5,1°. Ответ: 3,91 г. 177. Сколько граммов мочевины (NН2)2СО следует растворить в 250 г воды, чтобы температура кипения повысилась на 0,26°? Эбуллиоскопическая константа воды 0,52°. Ответ: 7,5 г. 178.При растворении 2,3 г некоторого неэлектролита в 125 г воды температура кристаллизации понижается на 0,372°. Вычислите мольную массу растворенного вещества. Криоскопическая константа воды 1,86°. Ответ: 92 г/моль. 179.Вычислите температуру кипения 15%-ного водного раствора пропилового спирта С3Н7ОН. Эбуллиоскопическая константа воды 0,52° .Ответ: 101,52°С. 180.Вычислите процентную концентрацию водного раствора метанола СН3ОН, температура кристаллизации которого –2,79°С. Криоскопическая константа воды 1,86°. Ответ: 4,58%.
|
||||||||||
|
Последнее изменение этой страницы: 2016-08-12; просмотров: 201; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.53.246 (0.009 с.) |

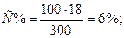
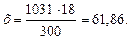
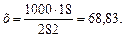
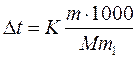 , (1)
, (1)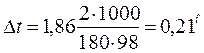 .
.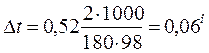 .
.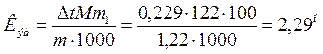 .
.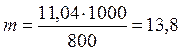 .
.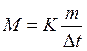 (2)
(2) .
.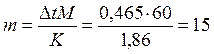 .
.


