
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Растворы. Приготовление растворов различных концентрацийСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Теоретическая часть Растворы – это однородные (гомогенные) системы, состоящие их двух и более компонентов (составных частей) и продуктов их взаимодействия. Важной характеристикой любого раствора является его количественный состав, который выражается концентрацией. Концентрацией раствора называют, количество растворенного вещества, содержащегося в определенном количестве раствора или растворителя. Существуют различные способы выражения концентрации растворов: процентная (по массе), молярная, нормальная, титр, мольная доля, мольная концентрация. Процентная концентрация (С % или W) определяет - процентное отношение массы растворенного вещества к общей массе раствора.
Молярная масса или молярность (
Размерность – Нормальная концентрация или нормальность (
Размерность Титр (Т) – это количество растворенного вещества в граммах, содержащихся в 1 мл раствора. Расчет титра в зависимости от нормальности производится по формуле:
Размерность Мольная доля ( Мольная доля – безразмерная величина. Сумма мольных долей всех компонентов раствора всегда равна единице. (
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Опыт 1. Приготовление раствора заданной концентрации из навески Этот способ применяется главным образом для приготовления растворов солей. 1. Получите у преподавателя номер вашего варианта (см. табл. 1) 2. Рассчитайте количество вещества, необходимое для приготовления раствора заданной концентрации, взвесьте его на технических весах с точностью до 0.01 г. 3. Рассчитайте необходимое количество воды (исходя из массы соли и концентрации раствора), отмерьте воду мерным цилиндром. 4. Возьмите плоскодонную колбу и через воронку осторожно перенесите в нее навеску соли. Воду, отмеренную для растворения, вылейте через воронку в колбу небольшими порциями так, чтобы всю соль с воронки смыть в колбу. Закройте пробкой колбу, встряхните её несколько раз, чтобы вся соль полностью растворилась. 5. Измерьте плотность полученного раствора ареометром и проверьте по таблице правильность приготовления раствора. Для этого перелейте приготовленный раствор в цилиндр и осторожно опустите ареометр. Затем выньте ареометр и промойте его под водопроводной водой. Таблица 1 Варианты опыта
Опыт 2. Определение процентной (масс) концентрации раствора и пересчет её на молярную и процентную концентрацию Порядок проведения опыта 1. В стеклянный цилиндр с раствором соли (ваш вариант задачи) плавно опускают ареометр, так, чтобы он не касался стенок сосуда. Делают отсчет плотности. 2. В таблице 2. находят процентную концентрацию раствора. Если найденная плотность находится между двумя значениями в таблице, то процентную концентрацию находят интерполяцией по уравнению
где
По рассчитанной процентной концентрации определяют молярность и нормальность раствора.
где
Таблица 2
Вопросы и задачи 1. Что называется концентрацией раствора и способы её выражения. Дать определение и показать на конкретных примерах. 2. Сколько грамм KCl следует растворить в 100 граммах воды для получения 5%- ного раствора. 3. Какова процентная концентрация раствора, полученного в результате растворения 90г вещества в 180 г воды? 4. В 240 мл воды растворили 80 г соли, плотность воды равна 1 г/мл. Какова процентная концентрация. 5. Что означает 1 н Ca(OH)2, PbCl2, AgNO3, 2 M Al(OH)3, KNO3, CaCl2. Покажите расчетами. 6. Рассчитать навеску K2Cr2O7 для приготовления 2% раствора объемом в 250 мл, плотность равна 1,0347 г/мл. 7. Сколько граммов Na2SO3 потребуется для приготовления 5 л 8%-ного раствора, плотность которого 1,075. 8. Чем объяснить устойчивость истинных растворов. 9. Чему равна молярность и нормальность 3%-ного раствора FeCl3, плотность 1,037 г/мл. 10. Дать определение растворам. 11. Раствор содержит смесь солей: AgNO3, Ba(NO3)2 и Zn(CH3COO)2. К нему добавили избыток HCl. Написать ионные уравнения возможных реакций. 12. Написать уравнения ступенчатой диссоциации H2S. В каком направлении будут смещаться эти равновесия при добавлении HCl и NaOH? 13. На нейтрализацию 25 мл HCl неизвестной концентрации пошло 30 мл 0,1 н раствора NaOH. Вычислить нормальность и молярность, а также титр раствора HCl. 14. Попарно смешали растворы следующих веществ:
Между какими из указанных веществ возможны реакции обмена? Написать ионные реакции возможных реакций. 15. Какова нормальность 40%-ного раствора H2SO4 плотностью 1,3 г/см.
Лабораторная работа № 4
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 2855; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.144.50 (0.007 с.) |

 , где
, где – масса растворенного вещества
– масса растворенного вещества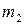 – общая масса раствора
– общая масса раствора ) выражается числом молей растворенного вещества, содержащегося в 1 литре раствора.
) выражается числом молей растворенного вещества, содержащегося в 1 литре раствора. , где
, где – молярная масса растворенного вещества
– молярная масса растворенного вещества – объем раствора (л)
– объем раствора (л)
 ) выражается числом растворенного вещества, содержащегося в 1 литре раствора
) выражается числом растворенного вещества, содержащегося в 1 литре раствора , где
, где – эквивалентная масса растворенного вещества,
– эквивалентная масса растворенного вещества,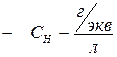
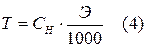 , где
, где
 ) – это отношение числа молей растворенного вещества
) – это отношение числа молей растворенного вещества  – к сумме числа молей всех компонентов раствора (
– к сумме числа молей всех компонентов раствора ( ).
). )
)
 – процентная концентрация,
– процентная концентрация,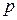 – плотность раствора,
– плотность раствора, 
 – ближайшее меньшее значение плотности в таблице,
– ближайшее меньшее значение плотности в таблице, – ближайшее большее значение плотности в таблице,
– ближайшее большее значение плотности в таблице, – % – концентрация раствора с плотностью,
– % – концентрация раствора с плотностью, – % – концентрация раствора с плотностью.
– % – концентрация раствора с плотностью.
 – рассчитанная процентная концентрация соли,
– рассчитанная процентная концентрация соли,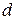 – соответствующая плотность,
– соответствующая плотность, – молярная масса соли.
– молярная масса соли.



