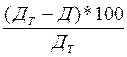Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Инженерно-технических специальностейСодержание книги
Поиск на нашем сайте
Лабораторный практикум предназначен для студентов высших учебных заведений инженерных специальностей, изучающих курс общей химии, для очной, очно-заочной и заочной форм обучения. В теоретическом материале каждого раздела рассматриваются основные законы и химические понятия, приводятся примеры химических реакций взаимодействия и решение задач. Лабораторные работы разработаны на основе, имеющихся на кафедре химико-технологических процессов, приборов и реактивов и сопровождаются перечнем вопросов для подготовки к их защите.
Составители: Михольская И.Н., доц., канд. биол. наук Лихачева Н.А., ассистент Фомина В.В., ассистент
Рецензенты: Газиев Р.Р., доц., канд. техн. наук Шеин В.П., инженер по подготовке производства II категориипроизводственного отдела ПДУ ОАО «Салаватнефтеоргсинтез», канд. техн. наук
Ó Уфимский государственный нефтяной технический университет, 2007 ВВЕДЕНИЕ Лабораторная работа № 1 ОПРЕДЕЛЕНИЕ МОЛЕКУЛЯРНОЙ МАССЫ КИСЛОРОДА Теоретическая часть Молекулярная масса вещества, число, которое показывает, во сколько раз молекула простого или сложного вещества тяжелее 1/12 части изотопа углерода 12, т.е. М= М - молекулярная масса вещества. mв - масса одной молекулы вещества. mo - масса одного атома углерода. Молекулярная масса является важной характеристикой вещества. Количество вещества в граммах, численно равное его молярной массе. называется молярной массой. В определении молекулярных и атомных масс большую роль сыграли газовые законы: 1. Закон Бойлля-Мариотта, который устанавливает зависимость объёма газа от давления при постоянной температуре: РV = P1V1., где V и V1 - объёмы газов данной массы при давлениях Р и P1. 2. Закон Гей-Люссака, устанавливающий зависимость объёма газа данной массы от температуры при постоянном давлении: VТ1= V1Т, где Vt и V - объёмы газов при температуре Т и Т1: 3. Закон Шарля, который устанавливает зависимость давление газов данной массы от температуры, при постоянном объеме РТ1-= Р1Т, где Р и Р1 – давления газов при температуре Т и Т1 4. Закон объёмных отношений, устанавливающий, что при одинаковых условиях, объёмы реагирующих между собой газов, а так же объёмы газообразных продуктов реакции, относятся друг к другу, как небольшие целые числа.
5. Закон Авогадро, устанавливающий, что при нормальных условиях (t=0°C, Р=101,31 кПа), молекула любого вещества содержит одно и тоже число структурных единиц равных 6,02*1023 моль 1, а молекула газообразного вещества занимает объём равный 22,4 л. Отношение массы определённого объёма газа к массе такого же объёма водорода, представляет собой плотность этого газа по-водороду, т.е. Mr = 2Д(H2). Молярную массу газа иногда вычисляют исходя из его плотности по воздуху, по формуле: Mr = 29Двозд, где 29 - средняя молярная масса газов воздуха, определяемая из плотности воздуха по водороду. В соответствии с законом Авогадро, лишь газообразные вещества при н.у. занимают объём равный 22,4 л, его называют молярным объёмом Vm Выше указанные методы расчёта молекулярных масс производят при н.у., т.е. t=0°C и Р=101,3 кПа. Если же условия отличаются от нормальных, то расчёт относительных молекулярных масс, производят по уравнению Клапейрона-Менделеева. Уравнение Клапейрона-Менделеева Р V = n R Т, где n-число молей вещества; R-универсальная газовая постоянная, равная 8,314; Т-температура по абсолютной шкале; соответственно Р и V -давление и объём газа; Так как n = ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ Определение молекулярной массы кислорода проводится на приборе, изображённом на рисунке:  5 5
1 4 6 3
1-колба с водой; 2-химический стакан; 3-сифон; 4-зажим; 5- стеклянная трубка; 6-тугоплавкая пробирка. Собрать прибор по рисунку. Колбу 1 залить водопроводной водой. В стакан 2 налить 50 мл воды. Заполнить сифон водой. Для этого через трубку 5 вдувать воздух в прибор при открытом зажиме 4, и, когда сифон заполнится водой, закрыть зажим 4. В сухую пробирку 6 насыпать около 1г перманганата калия. Пробирку с содержимым взвесить на весах с точностью до 0,01 г. Проверить герметичность. Опустить конец сифона в стакан 2. Открыв зажим 4, начать разложение соли, нагревая пробирку 6 слабым пламенем газовой горелки. Нагревание следует проводить весьма осторожно, периодически приближая и удаляя горелку от пробирки. При этом реакция разложения должна протекать не слишком интенсивно.
Когда в стакан 2 перекачается примерно 100-150 мл воды, прекратить нагревание, дать прибору охладится до комнатной температуры, после чего снова взвесить пробирку. Измерить объём вытесненной воды в стакане (из измеренного количества вычесть ранее добавленные 50 мл воды). Объём воды будет равен объёму полученного кислорода при температуре опыта. Определить вес полученного кислорода по разности веса пробирки до и после опыта. Ход работы и наблюдения свести в таблицу. Расчётная часть 1. Масса пробирки с содержимым до нагревания (г). 2. Масса пробирки с содержимым после нагревания (г). 3. Масса выделившегося кислорода (разность 1. и 2.) (г). 4. Объём воды в стакане после опыта (мл). 5. Объём воды в стакане до опыта (мл). 6. Объём вытесненной воды, равный объёму выделившегося кислорода в условиях опыта (разность 4. и 5.) (мл). 7. Объём кислорода приведённый к нормальным условиям (мл). 8. Температура воздуха в лаборатории (0С) 9. Атмосферное давление (кПа). 10. Давление водяных паров при температуре опыта (кПа) таблица 1. 11. Давление кислорода в колбе (разность 9. и 10.) (кПа). Объём кислорода, выделившегося во время опыта, определяется по формуле: V= Молекулярную массу определяем по формуле Клайперона-Менделеева. PV= nRT; так как n= Подставив в искомое уравнение получим: PV= Вычислим процент ошибки по формуле: %= где Дт - теоретические данные газа, Д - опытные данные газа. Таблица 1. Давление насыщенного пара воды при различной температуре
Вопросы и задачи 1. Методы расчёта молекулярных масс при н.у. и условиях отличных от нормальных. 2. Вычислить какой объём (н.у.) займёт 1г H2,CH4,NO2,NO,NH3,O3. 3. Вычислить массу 1 м3 газов (н.у.) N2O, SiF4, SO2. 4. Масса 200мл ацетилена (н.у.) равна 0,232 г. Вычислить молекулярную массу ацетилена. 5. Вычислить массу азота, содержащегося в баллоне ёмкостью 20л при Р=80атм и 250С. 6. Масса 87мл пара при t=620C и 758мм.рт. столба равна 0,24г. Вычислить молекулярную массу азота. 7. Вычислить массу 1 м3 воздуха при t=170C P=624 мм. рт. столба; массу 1 м3 СО2 при t=270C и Р=1 атм. 8. Вычислить объём, который займёт при t=170C и Р=1 атм. 1 кг воздуха. 9. Масса 20 мл газа (н.у.) равна 0,0268 г. Вычислить молекулярную массу газа. 10. Вычислить, какие газы тяжелее или легче воздуха: NO2; CO; Cl2; NH3; NO; F2 и во сколько раз.
Лабораторная работа № 2
|
|||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 791; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.213.73 (0.009 с.) |


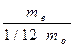 , где
, где ; то получим: Р V =
; то получим: Р V = 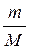 R Т; отсюда М =
R Т; отсюда М =  .
.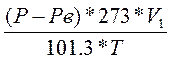 ;
; ;
; RT; отсюда M=
RT; отсюда M=  ;
;