
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1 Тепловой эффект растворенияСодержание книги
Поиск на нашем сайте
Выполнение опыта: нлейте в фарфоровый стаканчик 1/2 по объему воды, замерьте термометром температуру. Засыпьте в стаканчик 2-3 лопаточки соли NH4NO3, NaCl, NH4Cl. Перемешайте, чтобы образовался раствор, замерьте снова температуру. Запись данных опыта: как изменяется энтальпия в процессе растворения этих солей? С чем это связано?
Опыт 2 Дегидратация медного купороса и гидратация сульфата меди. Выполнение опыта: в сухую пробирку поместить 2-3 лопаточки медного купороса. Закрепите пробирку в штативе, так чтобы дно ее было чуть выше, чем отверстие. Нагрейте соль, находящуюся в пробирке (в начале нагревают всю пробирку, а потом дно, т.е. саму соль.) Какие изменения происходят с солью? Когда вся соль изменит свой цвет, прекратите нагревание, дайте пробирке остыть. Затем к остывшей соли добавьте несколько капель воды. Что наблюдается? Запись данных опыта: объясните происходящие в пробирке явления уравнением реакции. Объясните различие цвета безводной соли и кристаллогидрата
Опыт 3 Окраска некоторых кислотно-основных индикаторов в кислой, нейтральной и щелочной средах. Выполнение опыта: налейте в 6 пробирок по 10 капель дистиллированной воды. В две крайние левые добавьте 2 капли 2н. раствора НСl, в две крайние правые 3 капли 2н. раствора NaOH, а в две средние ничего не добавляйте. Теперь в три пробирки внесите по 1 капле фенолфталеина, в другие три по 1 капле метил - оранжевого. Отметьте окраску индикаторов в каждой из пробирок. Запись данных опыта: результат опыта запишите в виде таблицы: Таблица 1 Окраска индикаторов в зависимости от рН среды
В каком интервале шкалы рН метилоранж имеет желтую окраску, а фенолфталеин бесцветен? Объясните изменение цвета индикаторов в различной среде.
Реакции обмена в растворах электролитов Опыт 4 Смещение ионного равновесия Выполнение опыта: а) в две пробирки внесите по 5-7 капель 0,1н раствора уксусной кислоты и по 1 капле метилового оранжевого. В одну из пробирок внесите по 1-2 лопаточки сухой соли ацетата натрия.Что происходит? Объясните б) в две другие внесите по 5-7 капель 0,1 раствора аммиака и по одной капле фенолфталеина. В одну из пробирок внесите 1- 2 лопаточки сухой соли хлорида аммония.
Запись данных опыта: Отметьте в обоих опытах наблюдаемые явления. В каком направлении наблюдается смещение равновесия диссоциации слабых электролитов уксусной кислоты и гидроксида аммония, при добавлении к их растворам сильных электролитов с одноименным ионом? Составьте уравнения диссоциации уксусной кислоты, гидроксида аммония и выражение константы их равновесия. Увеличивается или уменьшается степень диссоциации уксусной кислоты, гидроксида аммония в результате добавления солей?
Опыт 5 Реакция с образованием слабого электролита. Выполнение опыта: а) внести в пробирку по 2-3 капли хлорида железа и такое же количество едкого натра. Во вторую пробирку внести несколько капель ацетата натрия и несколько капель серной кислоты (1:1), перемешать раствор стеклянной палочкой и слегка нагреть. Определите по запаху, что образовалась уксусная кислота. б) в третью и четвертую внесите по 5-7 капель раствора карбоната натрия. Проверьте наличие в растворе иона СО3, для чего в одну пробирку добавьте несколько капель хлорида кальция. Какое вещество выпало в осадок? В другую пробирку добавьте несколько капель серной кислоты (1:1) и наблюдайте выделение газа. Пробирку слегка подогрейте, дождитесь конца реакции и добавьте несколько капель раствора хлорида кальция. Запись данных опыта: выпадает ли осадок? Почему? Составьте в ионном виде все происходящие реакции.
Опыт 6 Условия выпадения и растворения осадков. Произведение растворимости. Выполнение опыта: а) в две пробирки поместить по 15-20 капель 0,005н раствора нитрата свинца. В одну из них добавить такой же объем 0,05н раствора иодида калия, в другую такой же объем 0,05н раствора хлорида калия. В какой из пробирок выпал осадок? Запись данных опыта: составьте уравнения происходящих реакций. Вычислив концентрацию ионов Pb и Cl, Pb и J и сравнив с произведением растворимости соответственно PbCl2 и PbJ2, объясните образование осадка только в одном случае. Полученные данные свести в таблицу: Таблица 2 Возможности образования осадка
Выполнение опыта: б) налейте в пробирку 2-3 капли раствора хромата калия и добавьте 1-2 капли нитрата серебра. Отметьте цвет образовавшегося малорастворимого хромата серебра, после чего добавьте к содержимому пробирки 2- 3 капли раствора хлорида натрия. Как изменился цвет осадка? Добавьте 3-4 капли сероводородной воды и отметьте изменение цвета осадка.
Запись данных опыта: составьте ионные уравнения реакций. Зная ПР хромата серебра, хлорида серебра, сульфата серебра, вычислите в каждом отдельном случае концентрацию ионов серебра. Обоснуйте последовательные переходы малорастворимого соединения в менее растворимые. Результаты расчетов оформите в таблице:
Таблица 3
Опыт 7 Гидролиз солей, факторы, влияющие на гидролиз
Выполнение опыта: в четыре пробирки насыпать по одной лопаточке солей: карбоната натрия, сульфата алюминия, ацетата аммония и хлорида калия. Добавьте в каждую пробирку дистиллированную воду до полного растворения солей. Определите при помощи универсальной индикаторной бумаги рН полученных растворов. Запись данных опыта: какие из названных солей подвергаются гидролизу? Составьте ионно-молекулярные уравнения реакций гидролиза. Зная константы диссоциации слабых электролитов, вычислите константу гидролиза по 1-ой ступени каждой соли. На основании полученных данных, определите какая из солей больше гидролизуется.
Вопросы и задачи 1.Объяснить, почему растворы солей могут иметь: а) кислую реакцию; б) щелочную; в) нейтральную. Привести примеры. 2.Написать ионные молекулярные уравнения реакции гидролиза с указанием изменения рН при растворении в воде следующих солей: сульфата цинка, нитрата калия, хлорида цезия, сульфата хрома (Ш). 3.Закончить уравнение реакции с учетом возможности необратимого гидролиза образуемых солей: AlCl 3 + Na2CO3 + H2O 4.К 330мл Н2O было прибавлено 1 мл 72% азотной кислоты (d=1,43). Определить рН полученного раствора. 5.К 55мл 0,2н раствора КОН прибавили 45 мл 0,2 н раствора HCl. Чему равен рН полученного раствора? 6.Чему равен рН раствора содержащего 2*10 г-ион/л Н 7.РН раствора 2,63. Чему равны в нем концентрации Н и ОН? 8.Во сколько раз увеличится концентрация ионов водорода, если величина рН раствора уменьшилась от 7 до 4? 9. Какие ионы в растворах 10. Как влияет температура на гидролиз солей? 11. Напишите уравнения реакций и рассчитайте константы гидролиза по первой ступени следующих солей:
Лабораторная работа № 6
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 694; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.128.191 (0.008 с.) |

 ,
,  ,
,  ,
, 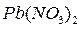 ,
, 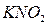 ,
,  ,
, 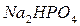 ,
,  ,
,  ,
,  ,
, 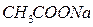 проявляют свойства кислот или оснований?
проявляют свойства кислот или оснований? ,
, 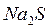 ,
,  ,
, 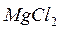 ,
, 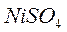 ,
, 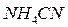 . В какую сторону смещено равновесие реакций?
. В какую сторону смещено равновесие реакций?


