
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Скорость химических реакций. Химическое равновесиеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Понятие о химической кинетике. Скорость химических реакций . Термодинамический подход к описанию химических процессов позволяет оценить энергию взаимодействия и вероятность направления протекания реакции. При этом рассматриваются только равновесные системы, т.е. процессы, которые протекают бесконечно медленно. С этих позиций невозможно анализировать развитие процесса во времени, т.к. время (как переменная) неустойчиво при термодинамическом описании. Поэтому, вторым этапом в изучении закономерности протекания химических процессов является рассмотрение их развития во времени. В обычных условиях протекание химических процессов связано с преодолением энергетических барьеров, которые могут быть весьма значительными. Поэтому термодинамическая возможность осуществления данной реакции (ΔG~0) является необходимой. Основополагающим понятием в химической кинетике является понятие о скорости химической реакции. Скорость химической реакции - это количество элементарных актов взаимодействия в единицу времени. Рассмотрим реакцию общего вида А + В = АВ, протекающую при постоянном давлении и температуре. Если концентрация А в момент времени t о равна Со, то за время t1 (t1< tо) концентрация А уменьшиться до С, за счет образования продуктов реакций, С1 < Со. За промежуток времени (t1 – tо); концентрация вещества А изменилась С1 – Со, т.е. средняя скорость изменения концентрации А выразится следующим образом:
Знак “минус”, стоящий перед дробью, означает снижение концентрации вещества А.. Аналогичное выражение для скорости изменения концентрации АВ имеет вид:
Знак "плюс" означает увеличение концентрации АВ. Эти формулы позволяют учесть и систему, в которой идет реакция. В случае, если реакция протекает в гомогенной фазе, то
Если реакция протекает в гетерогенной фазе, то учитывается площадь поверхности раздела фаз S:
Химическое равновесие Многие химические реакции идут не до полного исчезновения исходных веществ, а до состояния, не изменяющегося во времени, когда в реакционной смеси можно обнаружить как исходные вещества, так и продукты реакции. Такое состояние системы называется химическим равновесием. С точки зрения термодинамики состояние равновесия характеризуется тем, что система достигает минимального значения энергии Гиббса при заданных температуре, давлении и общем составе. С точки зрения кинетики химическое равновесие устанавливается тогда, когда скорости образования продуктов реакции из исходных веществ и из продуктов реакции выравниваются между собой. Химическое равновесие является неизменным во времени только при отсутствии внешнего воздействия. При наличии внешних воздействий (изменение температуры, давления, концентрации реагентов) система реагирует на них, переходя в другое равновесное состояние. В зависимости от природы процесса, условий, а также наличия или отсутствия катализаторов время достижения равновесия может меняться от малых долей секунды до веков и тысячелетий. Когда равновесие достигнуто, для реакции:
величина
называемая константой равновесия, принимает определенное значение. Выражение (2) называется законом действующих масс, где Если в химической реакции участвуют твердые вещества, например:
или
в выражении константы равновесия их концентрации отсутствуют. Это связано с тем, что в процессе реакции меняются только количества твердых веществ, но не меняется их «концентрация». Константы равновесия имеют вид:
Если химическая реакция протекает в разбавленном растворе и изменением концентрации растворителя в процессе реакции можно пренебречь, его концентрация также не входит в выражение для константы равновесия, например:
Константа равновесия не зависит от концентрации реагентов. Например, для реакции
соотношение равновесных концентраций Изменение равновесных концентраций в результате внешнего воздействия называется смещением химического равновесия. Основным законом, указывающим направлением смещения равновесия при внешних воздействиях, является принцип Ле-Шателье: Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, смещающее это равновесие, то смещение происходит в сторону, ослабляющую воздействие, до тех пор, пока нарастающее в системе противодействие не станет равным оказываемому действию. Внешним воздействием, смещающим равновесие, может быть изменение температуры, давления или концентрации одного или нескольких веществ, участвующих в реакции. При нагревании, т.е. сообщении системе теплоты, преимущество получает эндотермический процесс, сопровождающийся поглощением теплоты и препятствующей тем самым повышению температуры системы. При охлаждении, отнятии у системы теплоты, преимущество получает экзотермический процесс, восполняющий до некоторой степени потерю теплоты в системе и препятствующий понижению ее температуры, т.е. и в первом и во втором случае в системе возникает противодействие, ослабляющее внешнее воздействие. Иными словами, для экзотермической реакции (6) повышение температуры смещает равновесие влево, в сторону образования исходных веществ (азота и водорода), а понижение – вправо, в сторону образования продуктов реакции (аммиака). При уменьшении объема системы в результате повышения давления преимущество получает процесс, сопровождающийся образованием веществ меньшего объема; при этом давление в системе повышается не столь значительно, как в отсутствие такого процесса. И наоборот. Для реакции (6) повышение давления сместит равновесие вправо, а понижение – влево. При увеличении концентрации одного из реагентов получает преимущество реакция его расходования и равновесия смещается вправо. При увеличении концентрации одного из продуктов равновесие реакции смещается в сторону образования исходных реагентов. Такие воздействия, как освещение, приложение электрического или магнитного поля и т.п., на состояние равновесия, как правило, не влияют. Частным, но очень важным случаем установления химического равновесия является процесс образования (выпадения) осадка, например:
или, обратный ему, процесс растворения осадка:
Константы равновесия этих процессов имеют следующий вид:
для реакции (7) и
для реакции (8). На практике всегда используют вторую константу (9), которую называют произведением растворимости и обозначают ПР. Очевидно, что для малорастворимой соли состава Зная величину ПР, можно вычислить концентрацию ионов соли в насыщенном растворе, т.е. ее растворимость. Кроме того, если в растворе содержатся известные концентрации ионов Условие выпадения осадка имеет вид:
Если в растворе над осадком понизить концентрацию одного из ионов, то произведение концентраций Например, равновесие:
при добавлении
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ 0пыт 1. Влияние среды на смещение химического равновесия Соли хромовой кислоты - хроматы - окрашены в желтый цвет, а соли дихромовой кислоты – дихроматы – в оранжевый цвет. В растворах этих солей имеет место равновесие:
которое легко смещается при изменении концентрации ионов водорода.
Выполнение работы: в пробирку внести 5-6 капель раствора дихромата калия и прибавить столько же капель разбавленного раствора гидроксида натрия. Наблюдать переход окраски. Затем к этому же раствору по каплям прибавить раствор серной кислоты до тех пор, пока окраска раствора станет прежней. Запись данных опыта: объяснить, исходя из принципа Ле-Шателье, изменение окраски раствора.
0пыт 2. Влияние концентрации реагирующих веществ на смещение химического равновесия
|
||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 522; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.119.220 (0.011 с.) |



 , где V - объем реакционной среды.
, где V - объем реакционной среды.
 ,
,

 ,
,  и т.д. – равновесные молярные концентрации реагирующих веществ и продуктов в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении реакции.
и т.д. – равновесные молярные концентрации реагирующих веществ и продуктов в степенях, равных соответствующим стехиометрическим коэффициентам в уравнении реакции. ,
,
 ,
,
 – для реакции (3) и
– для реакции (3) и  – для реакции (4).
– для реакции (4). ,
,
 .
.
 ,
,  ,
, 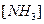 при заданной температуре не зависит от того, имелись ли в начале процесса чистые азот, водород, аммиак или их смесь.
при заданной температуре не зависит от того, имелись ли в начале процесса чистые азот, водород, аммиак или их смесь.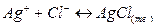
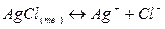


 .
. и
и  , можно установить, выпадет ли из этого раствора осадок соли или нет.
, можно установить, выпадет ли из этого раствора осадок соли или нет. .
. станет меньше ПР, и осадок растворится.
станет меньше ПР, и осадок растворится.
 сместится вправо, за счет образования устойчивого комплекса
сместится вправо, за счет образования устойчивого комплекса  :
: .
. ,
,


