
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Взаимодействие нитрата ртути (II) с иодитом калияСодержание книги
Поиск на нашем сайте
Выполнение работы: несколько кристалликов сухих солей нитрата ртути (II), иодита калия поместить в сухую пробирку, в другую пробирку насыпать приблизительное количество этих же веществ в виде мелкого порошка, энергично встряхнуть обе пробирки. Наблюдать появление окраски 6 следствие образования иодида ртути (II). Отметить различную скорость течения реакции. Запись данных опыта: влияние какого фактора изменяет скорость? Написать уравнение происходящей реакции.
Растворение карбоната кальция в хлороводородной кислоте Выполнение работы взять два небольших, по возможности, одинаковых кусочка мела. Один из них положить на фильтровальную бумагу и стеклянной палочкой измельчить его в порошок. Полученный порошок поместить в коническую пробирку. В обе пробирки одновременно добавить одинаковое количество (10-20 капель) хлороводородной кислоты (плотность 1,19 г/см3). Отметить время полного растворения мела в каждом случае. Запись данных опыта: Написать уравнение соответствующей реакции. Почему скорость растворения мела в двух случаях различная?
Опыт5. Влияние катализаторов на скорость реакции. Каталитическое восстановление железа (III). Выполнение работы: в две пробирки внести 10 капель 0,5 н раствора роданида калия или аммония и по 1 капле 0, 5 н раствора хлорида железа (III). Что наблюдается? В одну пробирку добавить 1 каплю 1 н раствора сульфата меди. В обе пробирки внести по 10 капель тиосульфата натрия. Наблюдать различную скорость обесцвечивания растворов, которое происходит вследствие восстановления железа (III) до железа (II) тиосульфатом натрия ( Запись данных опыта: Отметить все наблюдаемые явления, написать уравнения реакций: а) взаимодействия железа (III) с роданидом калия, в результате которого образуется Fe(SCN)3 красного цвета; б) восстановления железа (III) в железо (II) тиосульфатом натрия, протекающего по уравнению:
Какую окраску имеет
Вопросы и задачи
1. Написать выражения константы равновесия для реакции: а) б) в) г) В каком направлении сместится равновесие в каждом случае при увеличении давления? 2. В каком направлении сместится равновесие следующих обратимых реакций а) б) при понижении температуры, при понижении давления. 3. Действием каких факторов можно сместить равновесие указанных реакций вправо: а) б) 4. Приведите по два примера обратимых и практически необратимых реакций. 5. Почему химическое равновесие называют динамическим, или подвижным? 6. Для следующих химических реакций напишите выражение для констант равновесия и укажите, каким воздействием можно сместить равновесие вправо:
Лабораторная работа № 5 ГИДРОЛИЗ СОЛЕЙ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Растворы солей, образованных слабыми кислотами или слабыми основаниями, практически никогда не имеют нейтральной реакции (pH = 7). Причиной такого поведения является то, что анионы слабых кислот, а также гидратированные катионы металлов проявляют соответственно свойства оснований или кислот, т.е. способны захватывать или отдавать протоны. Вода является амфолитом и способна проявлять свойства как кислоты, так и основания. Поэтому между анионами слабых кислот и водой и, соответственно, между гидратированными катионами металлов и водой возможно взаимодействие кислотно-основного типа. Рассмотрим в качестве примера две реакции:
В реакции (1) протон переходит от молекулы воды, выступающей в роли кислоты, к ацетатиону, проявляющему свойства основания, а в реакции (.2) – от молекулы воды гидратной оболочки аквакомплекса (кислота) к свободной молекуле воды растворителя (основание). Такое химическое взаимодействие между ионами солей с водой концентрации [ Следует отметить, что свойства аквакислот проявляют почти все гидратированные ионы металлов. Исключение составляют только ионы щелочных и щелочноземельных металлов, которые, имея сравнительно большие размеры и малый заряд, не могут вызвать отщепление протона от молекул гидратной оболочки. К реакциям гидролиза, как к равновесным процессам, применим закон действующих масс. Следовательно, для реакций (1), (2) можно записать выражения для констант равновесия, которые называются константами гидролиза:
или, для упрощения, не выписывая формулы молекул воды у гидратированных ионов алюминия,
Умножив числитель и знаменатель уравнения (3) на концентрацию ионов водорода
или, соответственно, с константой диссоциации образующегося слабого основания:
Таким образом, константа гидролиза может быть вычислена по константам диссоциации кислоты или основания, образующих данную соль, и константе автопротолиза (ионному произведению) воды В водных растворах с участием многозарядных катионов и анионов гидролиз протекает по стадиям, например:
Для описания гидролиза в растворе определенной концентрации можно использовать степень гидролиза h. Степень гидролиза – это отношение числа молекул (катионов или анионов), подвергшихся гидролизу, к общему числу молекул (катионов или анионов), введенных в раствор. Зная степень гидролиза, можно определить концентрации ионов Все соли, кроме образованных сильными кислотами и сильными основаниями ( Если соль образована слабым основанием и слабой кислотой, например
Экспериментальная часть
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 785; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.6.144 (0.006 с.) |

 ).
).
 ? Что явилось катализатором в данном опыте?
? Что явилось катализатором в данном опыте?









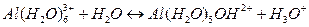 .
.
 ] и [
] и [  ] меняются, и, следовательно, раствор соли обнаруживает кислую и щелочную реакцию.
] меняются, и, следовательно, раствор соли обнаруживает кислую и щелочную реакцию.

 .
.
 , а уравнения (4) – на концентрацию гидроксид-ионов
, а уравнения (4) – на концентрацию гидроксид-ионов  и выполнив некоторые преобразования, получим выражение, связывающее константу гидролиза с константой диссоциации слабой кислоты:
и выполнив некоторые преобразования, получим выражение, связывающее константу гидролиза с константой диссоциации слабой кислоты: ,
,
 .
.

 .
.

 ,
,  и т.п.), в различной степени подвергаются гидролизу. Чем слабее кислота или основание, образующие соль, тем сильнее она гидролизована и тем больше pH ее раствора отличается от 7. Так, в растворе ацетата натрия
и т.п.), в различной степени подвергаются гидролизу. Чем слабее кислота или основание, образующие соль, тем сильнее она гидролизована и тем больше pH ее раствора отличается от 7. Так, в растворе ацетата натрия  pH» 8, а pH соли
pH» 8, а pH соли  , образованной более слабой угольной кислотой, близок к 11 (реакции 1,7 и 8).
, образованной более слабой угольной кислотой, близок к 11 (реакции 1,7 и 8). , гидролиз идет в существенно большей степени, т.к. образуется не один, а два слабо диссоциирующих продукта:
, гидролиз идет в существенно большей степени, т.к. образуется не один, а два слабо диссоциирующих продукта: .
.


