
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Массовая доля элемента в сложном веществеСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
С XVII в. химия перестала быть описательной наукой. Ученые-химики стали широко использовать измерение вещества. Все более совершенствовалась конструкция весов, позволяющих определять массы образцов. Для газообразных веществ помимо массы измеряли также объем и давление. Применение количественных измерений дало возможность понять сущность химических превращений, определять состав сложных веществ. Как вы уже знаете, в состав сложного вещества входят два или более химических элементов. Очевидно, что масса всего вещества слагается из масс составляющих его элементов. Значит, на долю каждого элемента приходится определенная часть массы вещества. Массовой долей элемента называется отношение массы этого элемента в сложном веществе к массе всего вещества, выраженное в долях единицы (или в процентах):
Массовая доля элемента в соединении обозначается латинской строчной буквой w («дубль-вэ») и показывает долю (часть массы), приходящуюся на данный элемент в общей массе вещества. Эта величина может выражаться в долях единицы или в процентах. Конечно, массовая доля элемента в сложном веществе всегда меньше единицы (или меньше 100%). Ведь часть от целого всегда меньше целого, как долька апельсина меньше всего апельсина. Например, в состав оксида ртути входят два элемента – ртуть и кислород. При нагревании 50 г этого вещества получается 46,3 г ртути и 3,7 г кислорода (рис. 57). Рассчитаем массовую долю ртути в сложном веществе:
Массовую долю кислорода в этом веществе можно рассчитать двумя способами. По определению массовая доля кислорода в оксиде ртути равна отношению массы кислорода к массе оксида:
Зная, что сумма массовых долей элементов в веществе равна единице (100%), массовую долю кислорода можно вычислить по разности: w (O) = 1 – 0,926 = 0,074, или w (О) = 100% – 92,6% = 7,4%. Для того чтобы найти массовые доли элементов предложенным способом, необходимо провести сложный и трудоемкий химический эксперимент по определению массы каждого элемента. Если же формула сложного вещества известна, та же задача решается значительно проще. Для расчета массовой доли элемента нужно его относительную атомную массу умножить на число атомов (n) данного элемента в формуле и разделить на относительную молекулярную массу вещества:
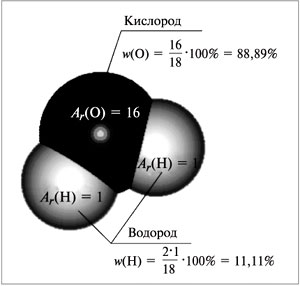
Например, для воды (рис. 58): Mr (H2O) = 1•2 + 16 = 18,
Далее рассмотрим решение задач на вычисление массовых долей элементов в сложных веществах. Задача 1. Рассчитайте массовые доли элементов в аммиаке, формула которого NH3. Дано: вещество аммиак NH3. Найти: w (N), w (H). Решение 1) Рассчитаем относительную молекулярную массу аммиака: Mr (NH3) = Ar (N) + 3 Ar (H) = 14 + 3•1 = 17. 2) Найдем массовую долю азота в веществе:
3) Вычислим массовую долю водорода в аммиаке: w (H) = 1 – w (N) = 1 – 0,8235 = 0,1765, или 17,65%. Ответ. w (N) = 82,35%, w (H) = 17,65%. Задача 2. Рассчитайте массовые доли элементов в серной кислоте, имеющей формулу H2SO4. Дано: серная кислота H2SO4. Найти: w (H), w (S), w (O). Решение 1) Рассчитаем относительную молекулярную массу серной кислоты: Mr (H2SO4) = 2 Ar (H) + Ar (S) + 4 Ar (O) = 2•1 + 32 + 4•16 = 98. 2) Найдем массовую долю водорода в веществе:
3) Вычислим массовую долю серы в серной кислоте:
4. Рассчитаем массовую долю кислорода в веществе: w (O) = 1 – (w (H) + w (S)) = 1 – (0,0204 + 0,3265) = 0,6531, или 65,31%. Ответ. w (H) = 2,04%, w (S) = 32,65%, w (O) = 65,31%. Чаще химикам приходится решать обратную задачу: по массовым долям элементов определять формулу сложного вещества. То, как решаются подобные задачи, проиллюстрируем одним историческим примером. Из природных минералов – тенорита и куприта – были выделены два соединения меди с кислородом (оксиды). Они отличались друг от друга по цвету и массовым долям элементов. В черном оксиде массовая доля меди составляла 80%, а массовая доля кислорода – 20%. В оксиде меди красного цвета массовые доли элементов составляли соответственно 88,9% и 11,1%. Каковы же формулы этих сложных веществ? Проведем несложные математические расчеты. Пример 1. Расчет химической формулы черного оксида меди (w (Cu) = 0,8 и w (О) = 0,2). 1) Обозначим формулу вещества с помощью индексов х, у – по числу атомов химических элементов в его составе: Сu x O y. 2) Отношение индексов равно отношению частных от деления массовой доли элемента в соединении на относительную атомную массу элемента:
3) Полученное соотношение нужно привести к соотношению целых чисел: индексы в формуле, показывающие число атомов, не могут быть дробными. Для этого полученные числа разделим на меньшее (т.е. любое) из них:
Получилась формула – СuO. Пример 2. Расчет формулы красного оксида меди по известным массовым долям w (Cu) = 88,9% и w (O) = 11,1%. Дано: w (Cu) = 88,9%, или 0,889, w (O) = 11,1%, или 0,111. Найти: формулу. Решение 1) Обозначим формулу оксида Сu x O y. 2) Найдем соотношение индексов x и y:
3) Приведем соотношение индексов к отношению целых чисел:
Ответ. Формула соединения – Cu2O. А теперь немного усложним задачу. Задача 3. По данным элементного анализа состав прокаленной горькой соли, использовавшейся еще алхимиками в качестве слабительного средства, следующий: массовая доля магния – 20,0%, массовая доля серы – 26,7%, массовая доля кислорода – 53,3%. Дано: w (Mg) = 20,0%, или 0,2, w (S) = 26,7%, или 0,267, w (O) = 53,3%, или 0,533. Найти: формулу. Решение 1) Обозначим формулу вещества с помощью индексов x, y, z: Mg x S y O z. 2) Найдем соотношение индексов:
3) Определим значение индексов x, y, z:
Ответ. Формула вещества – MgSO4.
2. Рассчитайте массовые доли элементов в веществах: а) углекислом газе CO2; 3. В каком из азотных удобрений массовая доля питательного элемента азота наибольшая: а) хлориде аммония NH4Cl; б) сульфате аммония (NH4)2SO4; в) мочевине (NH2)2CO?
5. Массовая доля азота в одном из его оксидов равна 30,43%, а массовая доля кислорода – 69,57%. Определите формулу оксида. 6. В средние века из золы костра выделяли вещество, которое называли поташ и использовали для варки мыла. Массовые доли элементов в этом веществе: калий – 56,6%, углерод – 8,7%, кислород – 34,7%. Определите формулу поташа. |
Чистые вещества и смеси
Один из самых любимых материалов скульпторов и архитекторов – мрамор (рис. 59). Окраска этой горной породы удивительно разнообразна: молочно-белая, серая, розоватая. Причудливый узор радует глаз. Мрамор послушен и податлив в руках мастера, он легко обрабатывается и прекрасно полируется до зеркального блеска. Мрамор – это минерал, материал, из которого можно изготовить облицовочную плитку, статую или колонну дворца. Плитка, статуя, колонна – это физические тела, изделия. А вот основу мрамора составляет вещество, которое называется карбонат кальция. То же вещество входит в состав других минералов – мела, известняка.

|
| Рис. 59. Мрамор – излюбленный материал скульпторов, художников, архитекторов |
Проследим логическую цепочку взаимосвязи понятий «физическое тело» – «материал» – «вещество» еще на нескольких примерах. Полезный предмет – линейка – сделан из материала пластмассы. Скорее всего, эта пластмасса – вещество полипропилен. Оконная рама – физическое тело, древесина – материал, целлюлоза – основное вещество древесины. Лезвие ножа – стальное, сталь – это сплав, основной компонент которого – вещество железо.
А теперь давайте подумаем, почему мрамор бывает разного цвета? Почему на его поверхности играет неповторимый узор? Потому, что помимо карбоната кальция в его состав входят примеси, придающие окраску. Аналогично и линейки бывают разного цвета, который зависит от того, какой краситель добавляют в пластмассу. В состав материала резины для изготовления автомобильных покрышек входит 24 компонента, важнейшим из которых является химическое вещество каучук.
|
|
Вот и получается, что чистых веществ в природе, в технике, в быту очень немного. Гораздо чаще встречаются смеси – сочетание двух или более веществ. Воздух – это смесь различных газов; нефть – природная смесь органических веществ (углеводородов); любые минералы, горные породы – это тоже твердые смеси различных веществ.
Смеси различаются величиной входящих в их состав частиц веществ. Иногда эти частицы настолько велики, что их можно видеть невооруженным глазом. Если смешать речной песок с сахарным, вы без труда отличите отдельные кристаллики друг от друга, особенно если будете пользоваться для этой цели увеличительным стеклом. К подобным смесям можно отнести, например, стиральный порошок, кулинарные смеси для выпечки блинов или тортов, строительные смеси.
Порой частички компонентов в смесях более мелкие, не различимые глазом. Например, в состав муки входят крупицы крахмала и белка, которые невозможно увидеть невооруженным глазом. Молоко – это тоже водная смесь, в которой содержатся маленькие капельки жира, белок, лактоза и другие вещества. Увидеть капельки жира в молоке можно, если рассматривать каплю молока под микроскопом.
Агрегатное состояние веществ в смеси может быть различным. Зубная паста, например, – это смесь твердых и жидких составляющих (рис. 60).

|
| Рис. 60. Зубная паста представляет собой гетерогенную смесь жидких и твердых компонентов |
|
| Поделиться: |




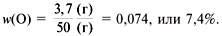







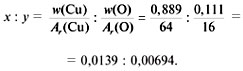



 1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?
1. Что называется массовой долей элемента в сложном веществе? Как рассчитывается эта величина?


