
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Формулы для пересчета концентраций растворовСодержание книги
Поиск на нашем сайте
В приводимой ниже таблице приняты следующие обозначения: М — мольная масса растворенного вещества, г/моль; Э — эквивалентная масса растворенного вещества, г/моль; р — плотность раствора, г/мл.
* Дли жидкостей может применяться величина Pv, % (об.) —число миллилитров растворенной жидкости в 100 мл раствора. РАСЧЕТНЫЕ ФОРМУЛЫ, ИСПОЛЬЗУЕМЫЕ ДЛЯ ПРИГОТОВЛЕНИЯ РАСТВОРОВ Для приготовления определенного количества раствора какого-либо вещества заданной концентрации исходят из следующих данных: а) из количества чистого вещества и растворителя; б) из количества раствора данного вещества с более высокой концентрацией, чем заданная, и количества чистого растворителя или в) из количества двух растворов того же вещества, один из которых имеет концентрацию больше нужной, а другой — меньше. Растворение вещества в воде Пусть требуется приготовить А граммов раствора концентрации P [в % (масс.) ]. Тогда: (I) где х— необходимая масса растворяемого вещества, г; b—необходимая масса воды, г. Если нужно приготовить определенный объем V раствора (в мл) концентрации Р, находят по таблицам плотность р (в г/см3) раствора данного вещества требуемой концентрации. Поскольку А = Vp, формула (1) будет иметь вид:
В тех случаях, когда растворяемое вещество представляет собой кристаллогидрат, т. е. содержит кристаллизационную воду, для расчета необходимого его количества используют формулу: (4) где х— необходимая масса кристаллогидрата, г; M1—мольная масса кристаллогидрата; М2—моль-мая масса вещества без кристаллизационной воды; b — необходимая масса воды, г. Если нужно приготовить раствор объемом V (в мл) заданной нормальности N, вычисляют значение эквивалентной массы Э растворяемого вещества, после чего находят необходимую его навеску (в г) по формуле:
При приготовлении раствора заданной молярной концентрации применяют аналогичную формулу:
где М — молярная концентрация раствора; Мв — мольная масса растворяемого вещества; V — заданный объем раствора, мл. Разбавление раствора водой Пусть требуется приготовить раствор концентрации Р2 из имеющегося раствора с более высокой концентрацией Р1. Обозначим массу раствора до разбавления А1, а массу раствора после разбавления— А2. Тогда массу воды b (в г), необходимую для разбавления, находят по формуле (8) или (9) в зависимости от того, задано ли значение А\ или А2. (8) (9) В тех случаях, когда известна не масса, а объем раствора, необходимо по таблицам найти плотности растворов данного вещества исходной и конечной концентраций — p1 и р2 соответственно. Тогда, если нужно приготовить раствор объемом V2 (в мл) концентрации Р2 [в % (масс.)], а концентрация исходного раствора равна P1 [(в % (масс.)], то объем исходного раствора вычисляется по формуле:
Объем воды (в мл) для разбавления: b = V2 - V1 Задача 6. Рассчитайте, сколько миллилитров раствора I пойдет на взаимодействие с раствором II. Реакции идут с образованием средних солей (плотности даны в г/мл).
Задача 7. В соответствии с приведенным планом охарактеризуйте два предложенных элемента.
План характеристики элемента по порядковому номеру:
1. Установите состав атома: число протонов (заряд ядра), нейтронов, электронов. 2. Запишите электронную формулу атома, укажите внешний электронный уровень и орбиталь, на которую идет последний электрон. Сделайте вывод о типе элемента. Изобразите электронно-структурную формулу валентного уровня. 3. Используя электронную формулу, определите положение элемента в периодической системе Д.И. Менделеева. 4. Определите возможные значения степеней окисления. Укажите наиболее устойчивые степени окисления для данного элемента. Приведите примеры соединений данного элемента в этих степенях окисления. 5. Исходя из электронной формулы определите характер свойств простого вещества (металл/неметалл). Опишите физические свойства простого вещества. Приведите уравнения реакций характеризующие химические свойства простого вещества. 6. Запишите формулы и приведите уравнения реакций, характеризующие химические свойства характеристических соединений: высшего оксида и высшего гидроксида. 7. Сделайте вывод о причинах сходства и различия предложенных элементов.
Образец выполнения домашнего задания по теме «Строение вещества», задача № 1 (Строение многоэлектронных атомов).
Элемент № 7 ( 1. Описать состав атома: число протонов, нейтронов, электронов:
2. Записать электронную формулу атома, указать внешний электронный уровень и орбиталь, на которую идет последний электрон. Сделать вывод о типе элемента. Изобразить электронно-структурную формулу валентного уровня:
Элемент семейства
3. Используя электронную формулу, определить положение элемента в периодической системе Д.И. Менделеева: Элемент находится: 2 период – т.к. максимальное значение главного квантового числа равно 2; V группа – т.к. число валентных электронов равно 5; главная подгруппа – т.к. последний электрон идет на 4. Определить допустимые значения степеней окисления. Указать наиболее устойчивые степени окисления для данного элемента. Привести примеры соединений данного элемента в устойчивых степенях окисления:
Устойчивость степеней окисления объясняется стабильностью электронной конфигурации атома в этих состояниях. В степени окисления
5. Исходя из электронной формулы определить характер свойств простого вещества. Охарактеризовать физические и химические свойства простого вещества: http://n-t.ru/ri/ps/ -СВ-ВА ВЕЩЕСТВ http://www.xumuk.ru/encyklopedia/2726.html Азот образует простое вещество – неметалл, т.к. атом на внешнем энергетическом уровне имеет 5 электронов и не имеет вакантных орбиталей. Физические свойства: Азот Химические свойства: химически азот весьма инертен, вступает в реакции при высокой температуре или в электрическом разряде:
При комнатной температуре реагирует только с литием:
6. Записать формулы и привести уравнения реакций, характеризующих химические свойства характеристических соединений: высшего оксида и гидроксида: Высший оксид –
Высший гидроксид –
Элемент № 73 ( 1. Описать состав атома: число протонов, нейтронов, электронов:
2. Записать электронную формулу атома, указать внешний электронный уровень и орбиталь, на которую идет последний электрон. Сделать вывод о типе элемента. Изобразить электронно-структурную формулу валентного уровня:
Элемент семейства
3. Используя электронную формулу, определить положение элемента в периодической системе Д.И. Менделеева: Элемент находится: 6 период – т.к. максимальное значение главного квантового числа равно 6; V группа – т.к. число валентных электронов равно 5; побочная подгруппа – т.к. последний электрон идет на 4. Определить допустимые значения степеней окисления. Указать наиболее устойчивые степени окисления для данного элемента. Привести примеры соединений данного элемента в устойчивых степенях окисления:
В степени окисления 5. Исходя из электронной формулы определить характер свойств простого вещества. Охарактеризовать физические и химические свойства простого вещества: Тантал образует простое вещество металл, т.к. на внешнем энергетическом уровне 2 электрона и в атоме много вакантных орбиталей. Физические свойства: Тантал – серый металл, мягкий, пластичный, тугоплавкий ( Химические свойства: Химически очень стоек. Не реагирует с водой, разбавленными кислотами и щелочами. Медленно окисляется концентрированной фтороводородной кислотой
При кипячении медленно взаимодействует с концентрированными растворами щелочей:
Окисляется кислородом и галогенами:
6. Записать формулы и привести уравнения реакций, характеризующих химические свойства характеристических соединений: высшего оксида и гидроксида: Высший оксид –
Высший гидроксид –
7. Сделать вывод о причинах сходства и различия предложенных элементов: Сходство этих элементов проявляется в одинаковом значении высшей степени окисления и, как следствие, одинаковой форме и близких химических свойствах высших оксидов и гидроксидов. Это объясняется одинаковым числом валентных электронов у обоих атомов. Однако в отличие от азота, у которого валентные электроны располагаются на внешнем уровне, у тантала 3 валентных электрона находятся на предвнешнем Задача 8.
С позиций метода валентных связей (МВС) объясните строение предложенных молекул. Укажите тип гибридизации центрального атома, изобразите перекрывание орбиталей, укажите порядки всех связей и их тип, определите, полярна ли данная молекула. http://www.alhimik.ru/stroenie/gl_10.html
http://www.chemistry.ru/course/content/chapter3/section/paragraph3/subparagraph5.html
http://www.bgtu-ief.com/index.php?option=com_content&view=article&id=219:-54-&catid=10:2010-12-27-17-54-56&Itemid=66
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 997; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.198.108 (0.007 с.) |


 (2)
(2) (3)
(3) (5)
(5) (6)
(6) (7)
(7)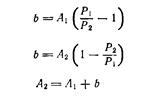 (10)
(10) (11)
(11)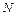 – азот).
– азот).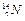

 – равно заряду ядра атома;
– равно заряду ядра атома;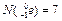 – равно числу протонов;
– равно числу протонов; .
.
 , так как последний электрон идет на
, так как последний электрон идет на 

 атом имеет полностью пустой 2 уровень:
атом имеет полностью пустой 2 уровень:  . В степени окисления
. В степени окисления  , орбитали 2-го уровня полностью заполнены (устойчивая 8-электронная оболочка благородного газа):
, орбитали 2-го уровня полностью заполнены (устойчивая 8-электронная оболочка благородного газа):  .
. ;
;
 - газ без цвета и запаха, в твердом состоянии белый,
- газ без цвета и запаха, в твердом состоянии белый, 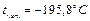 . Плохо растворяется в воде. Основной компонент воздуха
. Плохо растворяется в воде. Основной компонент воздуха 



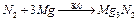

 – кислотный.
– кислотный.
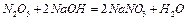

 – кислота.
– кислота.

 – Тантал).
– Тантал).
 – равно заряду ядра атома;
– равно заряду ядра атома; – равно числу протонов;
– равно числу протонов; .
.
 , так как последний электрон идет на
, так как последний электрон идет на 


 ), коррозионно-стойкий.
), коррозионно-стойкий.



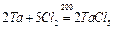
 – кислотный.
– кислотный.

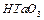 – кислота. На самом деле эта кислота представляет собой гидратированный оксид состава
– кислота. На самом деле эта кислота представляет собой гидратированный оксид состава  .
.

 -подуровней у тантала возможны все значения степеней окисления, лежащие в интервале между высшей и нулевой.
-подуровней у тантала возможны все значения степеней окисления, лежащие в интервале между высшей и нулевой.



