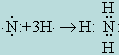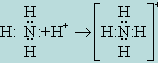Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Семинар «Модели строения атома и химической связи»Содержание книги
Поиск на нашем сайте
Радиальное распределение электронной плотности на р-, d-и f-орбиталях атома водорода Энергии s- и р-орбиталей атомов 1-го и 2-го периодов и Na Типы гибридизации орбиталей
Задача 9. По формуле соединения составьте названия комплексов и их формулы.
Номенклатура http://ru.wikipedia.org/wiki/%CA%EE%EC%EF%EB%E5%EA%F1%ED%FB%E5_%F1%EE%E5%E4%E8%ED%E5%ED%E8%FF Задача 10. Напишите молекулярные и ионные уравнения реакций образования комплексных соединений и формулу их общей константы нестойкости.
См. http://chem-bsu.narod.ru/umk_chem_webCD/Ch3/komplsoed.htm или
http://kurs.ido.tpu.ru/courses/Analyt_chem_1/tema9.htm
Образование комплексных соединений Комплексные соединения имеют сложный состав. В них выделяют центральный атом (комплексообразователь) и связанные с ним лиганды (заряженные или нейтральные неорганические или органические частицы, т. е. ионы или молекулы). Комплексообразователь вместе с лигандами составляет внутреннюю координационную сферу соединения. Кроме внутренней сферы, в большинстве случаев имеется также внешняя координационная сфера, состоящая из отрицательных или положительных ионов. Ионы внешней сферы связаны с комплексным ионом ионогенно, т. е. при растворении вещества в воде они отщепляются в виде свободных ионов. Наоборот, связь между комплексообразователем и лигандами имеет неионогенный характер, и вся внутренняя координационная сфера находится в водных растворах в виде комплексного иона. Так, в случае K[Ag(CN)2] комплексообразователем является Ag+, лигандами – CN-. Во внешней координационной сфере находятся К+ - ионы. Группа является внутренней сферой комплекса. Заряды комплексных ионов равняются алгебраической сумме зарядов комплексообразователя и лигандов. Так, заряд иона равен (+1) + (-2) = -1. Если лигандами являются нейтральные молекулы, их присутствие не отражается на заряде комплекса. Поэтому его заряд равен в таких случаях заряду комплексообразователя. Например, заряд иона [Ag(NH3) 2]+ такой же, как и у иона Ag+.
О заряде комплекса можно судить также по составу внешней координационной сферы. Найдя заряд комплекса, легко определить и степень окисления комплексообразователя, если она неизвестна. Так, в комплексном соединении K4 [Fe(CN)6] во внешней сфере находятся четыре однозарядных положительных иона К+, а поскольку вся молекула электронейтральна, заряд внутренней координационной сферы [Fe(CN)6]4- должен равняться 4-. Ионы CN-, являющиеся лигандами, несут в общей сложности 6 отрицательных зарядов, значит, комплексо-образователь должен иметь заряд, равный 2+. Общее число лигандов, координированных с данным комплексообразователем в комплекс, называется координационным числом комплексообразователя. У большинства комплексообразователей (Cr3+, Co3+, Fe2+, Fe 3+, Zn2+, Ni2+ и т. д.) координационное число равно 6. Координационное число 4 наблюдается у ионов Cd2+, Cu2+, Hg2+, Pt2+ и др. Существуют также комплексы, в которых комплексообразователь может иметь и другие координационные числа, например: 2, 3, 8 и т. д. Лигандами в большинстве случаев служат однозарядные отрицательные ионы, а также молекулы, подобные NH3, H2O, и другие, способные занимать лишь одно координационное место в комплексе. Известны лиганды, которые могут занимать сразу два и больше мест. Такие лиганды называются бидентатными, тридентатными и т. д., в зависимости от того, сколько мест во внутренней сфере комплексного соединения данный лиганд может занять. Способность к образованию комплексов всего сильнее проявляют элементы, расположенные в средней части больших периодов Периодической системы элементов Д. И. Менделеева (Cu, Ni, Co, Fe, Mn, Zn, Ag и т. д.). Общим методом получения комплексов типа присоединения является действие избытка комплексообразующего реагента на соли связываемого в комплекс иона. Например, HgCl2 + 4KI = K2[HgI4] + 2KCl Таким способом получают галогено-, родано-, циано-, нитро-, киcлородсодержащие и другие комплексные соединения. Общим методом получения комплексов, образующихся по типу внедрения, является действие аммиака или воды на соли связываемого в комплекс иона. Например, HgCl2 + 2NH4OH = [Ag(NH3)2]Cl + 2H2O Так получают аммиакаты и аквакомплексы. С позиций электронной теории образование комплексных соединений происходит как результат проявления сил электростатического притяжения, действующих между лигандами и ионом-комплексообразователем. Электростатическая теория Косселя (теория ионной связи) образование молекулы аммиака объясняет следующим образом. Нейтральный атом азота во внешнем электронном слое имеет 5 электронов и поэтому стремится дополнить это число до устойчивого октета (8 электронов). При реакции с атомами водорода электроны трех атомов водорода переходят к атому азота и образуется отрицательный N3- и три положительных H+. В результате взаимного притяжения образуется [NH3]. Теория ковалентной связи Льюиса образование комплексов объясняет возникновением ковалентной связи между ионами комплексообразователя и лигандами. Ковалентная связь осуществляется за счет электронных пар, общих для обоих соединяющихся атомов. Согласно этой теории молекула аммиака образуется в результате возникновения трех общих электронных пар, связывающих атомы водорода с атомом азота:
Теория ковалентной связи допускает возможность использования "свободной" пары электронов для осуществления связи с соответствующим ионом. В случае аммиака таким ионом является H+, в результате образуется ион NH+4:
Подобная связь, осуществляемая за счет электронной пары, принадлежавшей первоначально одному из соединяющихся атомов и как бы отдаваемой им в общее владение с другим атомом, называется координационной, или донорно-акцепторной связью. При этом атом, отдающий электронную пару, называют донором, а атом, получающий её,– акцептором. Лиганды в комплексных соединениях в большинстве случаев представляют собой атомы или группы атомов с одной или несколькими неподеленными парами электронов. К ним относятся галогенид-ионы, азотистые основания (аммиак, пиридин, алифатические амины и др.), гидроксил-ионы, некоторые органические соединения, содержащие карбоксильную (СООН-) и карбонильную (= С = О) группы, а также функциональные группы, имеющие в своем составе серу, фосфор или мышьяк. Донорными атомами в этих лигандах, как правило, являются галоген, азот, кислород, фосфор или мышьяк. Следующим этапом развития теории координационных соединений являются теория молекулярных орбиталей, которая развивает и углубляет теорию ковалентных связей, и теория строения кристаллического поля, которая основывается на электрохимических представлениях. Более полной теорией координационных соединений, объединяющей теорию молекулярных орбиталей и теорию кристаллического поля, является теория поля лигандов.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 921; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.94.64 (0.011 с.) |