
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Равные объемы растворов одинаковой нормальности содержат равные эквивалентные количества растворенных веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Более подробно о расчетах в объемном анализе см. соответствующую тему справочника по химии: Расчеты в объемном анализе
Эквивалент – это реальная или условная частица, которая в кислотно-основных реакциях присоединяет (или отдает) один ион Н+ или ОН–, в окислительно-восстановительных реакциях принимает (или отдает) один электрон, реагирует с одним атомом водорода или с одним эквивалентом другого вещества. Например, рассмотрим следующую реакцию: H3PO4 + 2KOH ® K2HPO4 + 2H2O. В ходе этой реакции только два атома водорода замещаются на атомы калия, иначе, в реакцию вступают два иона Н+ (кислота проявляет основность 2). Тогда по определению эквивалентом H3PO4 будет являться условная частица 1/2H3PO4, т.к. если одна молекула H3PO4 предоставляет два иона Н+, то один ион Н+ дает половина молекулы H3PO4. С другой стороны, на реакцию с одной молекулой ортофосфорной кислотой щелочь отдает два иона ОН–, следовательно, один ион ОН– потребуется на взаимодействие с 1/2 молекулы кислоты. Эквивалентом кислоты является условная частица 1/2Н3РО4, а эквивалентом щелочи частица КОН. Число, показывающее, какая часть молекулы или другой частицы вещества соответствует эквиваленту, называется фактором эквивалентности (f Э). Фактор эквивалентности – это безразмерная величина, которая меньше, либо равна 1. Формулы расчета фактора эквивалентности приведены в таблице 1.1. Таким образом, сочетая фактор эквивалентности и формульную единицу вещества, можно составить формулу эквивалента какой-либо частицы, где фактор эквивалентности записывается как химический коэффициент перед формулой частицы:
В примере, рассмотренном выше, фактор эквивалентности для кислоты, соответственно, равен 1/2, а для щелочи КОН равен 1. Между H3PO4 и КОН также могут происходить и другие реакции. При этом кислота будет иметь разные значения фактора эквивалентности: H3PO4 + 3KOH ® K3PO4 + 3H2O f Э(H3PO4) = 1/3 H3PO4 + KOH ® KН2PO4 + H2O f Э(H3PO4) = 1. Следует учитывать, что эквивалент одного и того же вещества может меняться в зависимости от того, в какую реакцию оно вступает. Эквивалент элемента также может быть различным в зависимости от вида соединения, в состав которого он входит. Эквивалентом может являться как сама молекула или какая-либо другая формульная единица вещества, так и ее часть. Таблица 1.1 – Расчет фактора эквивалентности
Пример. Определите фактор эквивалентности и эквивалент у солей: а) ZnCl2, б) КНСО3, в) (MgOH)2SO4. Решение: Для расчетов воспользуемся формулами, приведенными в таблице 1.1. а) ZnCl2 (средняя соль):
f Э(ZnCl2) = 1/2, поэтому эквивалентом ZnCl2 является частица 1/2ZnCl2. б) КНСО3 (кислая соль):
f Э(КНСО3) = 1, поэтому эквивалентом КНСО3 является частица КНСО3. в) (MgOH)2SO4 (основная соль):
f Э((MgOH)2SO4) = 1/2, поэтому эквивалентом (MgOH)2SO4 является частица 1/2(MgOH)2SO4. Задача 5. Рассчитайте, сколько миллилитров крепкого раствора I нужно взять, чтобы путем разбавления его водой приготовить заданный объем раствора II указанной концентрации.
TV=m=CVM m раствора=плотность*объем mв-ва=m раствора*w
mв-ва=mр-ра*w Vр-ра=mр-ра/плотность
, моль/л Таблица 1.1 – Расчет фактора эквивалентности
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 461; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.171.121 (0.006 с.) |

 ,
где В (Э) – валентность элемента
,
где В (Э) – валентность элемента


 ,
где n (Э) – число атомов элемента (индекс в химической формуле), В (Э) – валентность элемента
,
где n (Э) – число атомов элемента (индекс в химической формуле), В (Э) – валентность элемента
 ,
где n (H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
,
где n (H+) – число отданных в ходе реакции ионов водорода (основность кислоты)
 ,
где n (ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
,
где n (ОH–) – число отданных в ходе реакции гидроксид-ионов (кислотность основания)
 ,
где n (Ме) – число атомов металла (индекс в химической формуле соли), В (Ме) – валентность металла; n (А) – число кислотных остатков, В (А) – валентность кислотного остатка
,
где n (Ме) – число атомов металла (индекс в химической формуле соли), В (Ме) – валентность металла; n (А) – число кислотных остатков, В (А) – валентность кислотного остатка
 ,
где
,
где  – число электронов, участвующих в процессе окисления или восстановления
– число электронов, участвующих в процессе окисления или восстановления
 ® Fe0
f Э(Fe2+) =1/2;
MnO4– + 8H+ + 5
® Fe0
f Э(Fe2+) =1/2;
MnO4– + 8H+ + 5 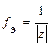 ,
где z – заряд иона
,
где z – заряд иона
 .
. .
. .
.


