
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методические указания по выполнению лабораторных работ (№1 - № 8)Содержание книги
Поиск на нашем сайте
Кафедра химии
Х И М И Я Методические указания по выполнению лабораторных работ (№1 - № 8) и организации подготовки к их защите студентами I курса специальностей 270800 - «Строительство»
БРЯНСК 2011 Брянская государственная инженерно-технологическая академия
Кафедра химии
УТВЕРЖДЕНО Научно-методическим советом БГИТА Протокол № ____ от_________2011г
Х И М И Я Методические указания по выполнению лабораторных работ (№1 - № 8) и организации подготовки к их защите студентами I курса специальностей 270800 - «Строительство»
БРЯНСК 2011
Составители: д.х.н., профессор А. А. Пашаян доцент И.А.Кулеш ст. препод. О.С. Винникова
Рецензент: к. х. н., доцент Щетинская О.С.
Рекомендовано учебно-методической комиссией строительного факультета
Протокол № _____ от «____»___________ 2011г.
СОДЕРЖАНИЕ
Общие методические указания
Настоящие методические указания наряду с методикой проведения опытов и обработки их результатов содержат методический материал, призванный помочь студенту в самоподготовке к защите тем лабораторных работ. Он включает теоретические пояснения к каждой работе, примеры решения типовых задач, перечень понятий и законов, которые должен знать студент, а также умений и навыков, которыми он должен обладать. В конце каждой темы приводятся задания для самоконтроля и список рекомендуемой литературы. Для более эффективного использования времени аудиторных занятий студент должен заранее ознакомиться с темой предстоящей работы, записать в лабораторный журнал название, цель, краткий конспект теоретической части, сжато описать методику проведения эксперимента. После выполнения лабораторной работы студенты защищают ее. Для этого они должны: предъявить отчет о выполнении работы, который оформляется в лабораторном журнале; уметь изложить ход проведения лабораторных опытов, объяснить результаты эксперимента; по просьбе преподавателя составить соответствующие уравнения реакций, произвести расчеты, не выходящие за рамки типовых задач. Лабораторная работа №1 Лабораторная работа № 2 Основные классы неорганических соединений: оксиды, основания и амфотерные гидроксиды Цель работы: изучить классификацию, номенклатуру, получение и химические свойства оксидов, оснований и амфотерных гидроксидов. Оборудование и реактивы: спиртовка, штатив с бюреткой, держатель для пробирок, пинцет, шпатели, фильтровальная бумага, пробирки, пипетки, стеклянная трубочка, фарфоровая чашка, индикаторы: фенолфталеин и метиловый оранжевый, дистиллированная вода, порошкообразные CuO, MgO, CaO, ZnO, металлические натрий, 0,5 н. растворы CuSO4, Al2(SO4)3, 2 н. растворы NaOH, H2SO4, HCl, 30% раствор NaOH.
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Все неорганические вещества можно разделить на простые и сложные. Сложные неорганические вещества по составу делятся на бинарные (оксиды, галогениды, сульфиды, гидриды, нитриды, карбиды и другие) и многоэлементные соединения. Оксиды – это сложные вещества, состоящие из двух элементов один из которых кислород в степени окисления -2. Соединения с фтором, где кислород проявляет положительную степень окисления, пероксиды (степень окисления – 1), супероксиды (степень окисления –1/2), озониды (степень окисления –1/3) оксидами не являются. По функциональным признакам оксиды делятся на солеобразующие (при взаимодействии с кислотами или основаниями дают соли) и несолеобразующие, которые не образуют солей, им не соответствуют гидроксиды с той же степенью окисления элемента, что и в оксиде. Несолеобразующие оксиды могут вступать с кислотами или основаниями только в окислительно-восстановительные реакции. Примером таких оксидов служат N2O, NO, CO, OsO4 и другие. Солеобразующие оксиды подразделяются на основные, кислотные (ангидриды кислот) и амфотерные. Основными называют оксиды, которым соответствуют основания. К ним относятся оксиды щелочных и щелочноземельных металлов, MgO, CuO, CdO, HgO, VO, CrO, MnO, FeO, NiO, CoO, Bi2O3 и другие. Основные оксиды взаимодействуют с кислотами и кислотными оксидами с образованием солей:
MgO + 2HCI → MgCI2 + H2O CaO + CO2 → CaCO3
Непосредственно с водой взаимодействуют оксиды щелочных и щелочноземельных металлов, частично MgO. При этом образуются основные гидроксиды (основания): CaO + H2O → Ca(OH)2 Кислотными называют оксиды, которым соответствуют кислоты. К ним относятся CO2, SiO2, SO2, SO3, P2O5, N2O3, NO2, N2O5, B2O3, CrO3, Mn2O7 и другие. Кислотные оксиды взаимодействуют с основаниями и основными оксидами с образованием солей: SO3 + 2NaOH → Na2SO4 + H2O SO3 + CaO → CaSO4 Многие из кислотных оксидов, за небольшим исключением (SiO2, TeO2, TeO3, MoO3, WO3 и другие), непосредственно взаимодействуют с водой, образуя кислородсодержащие кислоты: SO2 + H2O → H2SO3 SO3 + H2O → H2SO4 Амфотерными называют оксиды, которым соответствуют и основания и кислоты. К данным оксидам относятся BeO, ZnO, PbO, SnO, Al2O3, Cr2O3, MnO2, SnO2, PbO2, Sb2O3 и другие. Амфотерные оксиды взаимодействуют как с кислотами, так и с основаниями с образованием солей: AI2O3 + 6HCI → 2AICI3 + 3H2O AI2O3 + 2NaOH + 3H2O → 2Na[AI(OH)4] Эти оксиды непосредственно с водой не взаимодействуют. Как показывают приведенные примеры, с повышением степени окисления металла основные свойства их оксидов ослабевают, а кислотные усиливаются. Названия оксидов образуются следующим образом: - слово «оксид» и название элемента в родительном падеже с указанием в скобках римской цифрой его степени окисления (если элемент может проявлять несколько степеней окисления); - стехиометрические соотношения между элементами указываются при помощи греческих умножающих префиксов, присоединяемых без дефиса к названиям элементов (если в формуле свыше 12 атомов одного вида, то вместо префиксов используются цифры). Например, СО2 – оксид углерода (IV) или диоксид углерода, N2O – оксид азота (I) или оксид диазота, Fe3O4 – оксид дижелеза (III)-железа (II) или тетраоксид трижелеза, W20O58 – 58 – оксид 20 – вольфрама. Солеобразующим оксидам соответствуют гидроксиды – гидратированные оксиды. По кислотно-основным свойствам гидроксиды подразделяются на основные, кислотные и амфотерные. Основные гидроксиды (основания) диссоциируют в водных растворах с образованием в качестве анионов только ОН-: NaOH → Na+ + ОН- Ca(OH)2→ Ca2+ + 2ОН- Они подразделяются на нерастворимые, малорастворимые в воде основания (АI(OH)3, Cu(OH)2) и хорошо растворимые основания или щелочи (KOH, NaOH, Ca(OH)2). Важнейшее химическое свойство основных гидроксидов – способность взаимодействовать с кислотами и кислотными оксидами с образованием солей. К амфотерным относятся гидроксиды, которые реагируют как с основаниями, так и с кислотами: АI(OH)3 +3 HCI → AICI3 + 3H2O АI(OH)3 + NaOH → Na[AI(OH)4]
МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТОВ
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ
1. Знать номенклатуру основных классов неорганических соединений, в том числе традиционные названия наиболее распространенных оксидов и гидроксидов. 2. Знать классификацию и взаимосвязь между основными классами неорганических соединений, способы их получения и свойства. 3. Уметь составлять химические формулы по названию вещества и давать название веществу по его химической формуле. Лабораторная работа № 4 ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного остатка. Кислоты – это электролиты, которые в водных растворах или расплавах диссоциируют на ионы водорода и ионы кислотного остатка. Кислоты – это вещества способные в растворе отщеплять ион водорода. Выделяют кислородсодержащие кислоты (кислотные гидроксиды), бескислородные кислоты, летучие и нелетучие, одноосновные, двухосновные и трехосновные, сильные и слабые. Кислородсодержащие кислоты имеют общую формулу HxAyOz, где AyOzх-– кислотный остаток, А – кислотообразующий элемент. В номенклатуре кислородсодержащих кислот используются как тривиальные, так и систематические названия. Последние полностью отражают состав соединения и даются по правилам составления названий комплексных соединений. Систематические названия рекомендуется давать лишь малораспространенным кислотам, образованным элементами с переменной степенью окисления. Например, H6TeO6 – гексаоксотеллурат (VI) водорода. В традиционных названиях для обозначения степени окисления элемента А применяют суффиксы:
Примеры: HCIO4 – хлорная кислота; HCIO3 – хлорноватая кислота; HCIO2 – хлористая кислота; HCIO – хлорноватистая кислота; При взаимодействии между собой гидроксидов и оксидов, с различными кислотно-основными свойствами, образуются соли. Соли по составу подразделяются на простые, двойные, смешанные и комплексные. Двойные соли образованы двумя различными катионами и одним анионом. Например, NaAl(SO4)2 – сульфат алюминия-натия. Смешанные соли образованы несколькими различными анионами (кислотными остатками) и одним катионом. Например, CaCl(ClO) – хлорид-гипохлорит кальция или хлорная известь. Комплексные соли содержат в своем составе сложные комплексные ионы, которые в химических реакциях, процессах растворения, в структуре кристалла ведут себя как самостоятельные единицы. Например, K4[Fe(CN)6] - гексацианоферрат (II) калия диссоциирует в воде на ионы в соответствии с уравнением:
Комплексный анион практически не диссоциирует в водном растворе, поэтому Fe2+ не обнаруживается качественными реакциями. Простые соли по характеру замещения подразделяются на средние (нормальные), кислые и основные. Средние соли, например, CuSO4, Na2CO3 и другие, являются продуктами полного замещения ионов водорода в кислоте на другие катионы или продуктами полного замещения гидроксильных групп в основании на кислотные остатки. Кислые соли можно рассматривать как продукты неполного замещения ионов водорода в двух- или более основной кислоте на другие катионы. Кислые соли получаются при взаимодействии кислоты или кислотного оксида с недостатком основания, либо взаимодействием средней соли с кислотой или кислотным оксидом: H2SO4 + КOH → КHSO4 + H2O; CO2 + NaOH → NaHCO3; Вa3(PO4)2 + H3PO4→ 3 ВaHPO4; CaCO3 + CO2 + H2O → Ca(HCO3)2. Так как в анионе кислой соли содержится подвижный водород, то она частично сохраняет свойства кислоты и может вступать в реакцию нейтрализации с основаниями: NaHSO4 + KOH = NaKSO4 + H2O. Основные соли можно рассматривать как продукты неполного замещения ОН – групп в многокислотных основаниях на кислотные остатки. Эти соли получаются при взаимодействии основания с недостатком кислоты или средней соли: Ва(OH)2 + HCl = ВаOHCl + H2O; CoCl2 + КOH = CoOHCl¯ +КCl. Так как в состав основных солей входят гидроксильные группы, то они могут взаимодействовать с кислотами с образованием средних солей. Таким образом, основные соли частично сохраняют свойства оснований: MgOHCl + HCl = MgCl2 + H2O Систематические названия солей связаны с систематическими названиями соответствующих кислот. Традиционные названия солей кислородсодержащих кислот составляются из названия аниона в именительном падеже и катиона в родительном падеже. Название аниона включает корень русского или латинского названия кислотообразующего элемента с добавлением суффикса, соответствующего степени окисления элемента. При этом возможны следующие случаи: - если кислотообразующий элемент имеет только одну степень окисления, то добавляется суффикс –ат: Na2CO3 – карбонат натрия; - если кислотообразующий элемент имеет две степени окисления, то при высшей из них к корню добавляется суффикс –ат, а при низшей – - ит: CaSO4 – сульфат кальция, Na2SO3 – cульфит натрия; - если имеются анионы, отвечающие четырем степеням окисления кислотообразующего элемента, то для высшей степени окисления используется приставка пер- и суффикс -ат (КCl+7O4 – перхлорат калия), - затем суффикс –ат (KCl+5O3 – хлорат калия), суффикс –ит (KCl+3O2 – хлорит калия) и для наименьшей степени окисления – приставка гипо- и суффикс –ит (KCl+1O - гипохлорит калия). В названиях анионов солей бескислородных кислот используется суффикс –ид (K2S - сульфид калия). При построении традиционных названий кислых солей к названию аниона средней соли добавляется приставка гидро- и числовая греческая приставка, если число атомов водорода в анионе больше одного (Ca(H2PO4)2 – дигидрофосфат кальция, Ca(HCO3)2 – гидрокарбонат кальция). Традиционные названия основных солей формируются при помощи приставки гидроксо- и при необходимости соответствующей числительной приставки ((CuOH)2CO3 – карбонат гидроксомеди (II)). МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТОВ
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ
1. Знать номенклатуру основных классов неорганических соединений, в том числе традиционные названия наиболее распространенных кислот и их солей. 2. Знать классификацию и взаимосвязь между основными классами неорганических соединений, способы их получения и свойства. 3. Уметь составлять химические формулы по названию вещества и давать название веществу по его химической формуле. Лабораторная работа № 5 Кинетика химических реакций Цель работы: изучение скорости химической реакции и ее зависимости от различных факторов: природы реагирующих веществ, концентрации, температуры. Оборудование и реактивы: химический стакан, термометр, штатив с пробирками, электроплитка, лучина, дистиллированная вода, 0,1М раствор НС1, 1,0 н, раствор H2SO4, 0,05 н раствор Na2S2O3, мел. ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Кинетика – наука о скорости химических реакций. Скоростью химической реакции называют изменение концентрации реагирующего вещества в единицу времени. Скорость реакции зависит от ряда факторов: природы реагирующих веществ, концентрации реагирующих веществ, температуры, наличия катализатора. 1) Зависимость скорости реакции от концентрации выражается законом действующих масс: при постоянной температуре скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ, взятых в степенях, равных стехиометрическим коэффициентам. Например, для реакции Н2(г) + I2 (г) → 2HI(г) закон действующих масс может быть записан Реакции в гетерогенной системе осуществляются на поверхности раздела между фазами. Поэтому скорость гетерогенных реакций при постоянной температуре зависит не только от концентрации веществ, но и от площади поверхности раздела. Так, для реакции: С(к) + О2(г) → СО2(г) закон действующих масс имеет вид 2) Зависимость скорости реакции от температуры выражается правилом Вант-Гоффа:
где v1 и v2 скорости реакции при Т2 и Т1, 3) Одним из методов ускорения химической реакции является катализ, который осуществляется при помощи веществ (катализаторов), увеличивающих скорость реакции, но не расходующихся в результате ее протекания. Механизм действия катализатора сводится к уменьшению величины энергии активации реакции, т.е. к уменьшению разности между средней энергией активных молекул (активного комплекса) и средней энергией молекул исходных веществ. Скорость химической реакции при этом увеличивается. Опыт 1 Зависимость скорости реакции от концентрации реагирующих веществ.
Зависимость скорости реакции от концентрации реагирующих веществ изучают на примере взаимодействия тиосульфата натрия с серной кислотой: Nа2S2О3 + Н2S04 = S02 + Nа2S04 + H2O + S Признаком реакции является помутнение раствора вследствие выделения серы. Заполните три бюретки: первую – 1н раствором Н2S04, вторую – 0,05 н раствором Nа2S2О3, третью — водой. Приведите бюретки в рабочее положение. Налейте в три пробирки из бюретки по 1 мл Н2S04. В другие три пробирки из бюреток налейте: в первую — 1 мл раствора Nа2S2О3 и 2 мл воды; во вторую – 2 мл раствора Nа2S2О3 и 1 мл воды; в третью – 3 мл раствора Nа2S2О3 и 0 мл воды. Заметив время, в первую пробирку прилейте из пробирки 1 мл отмеренного раствора серной кислоты и быстро перемешайте полученную смесь. Отметьте время начала помутнения раствора. Проделайте то же самое с двумя оставшимися пробирками. Рассчитайте vпракт для второго и третьего случаев, учитывая, что скорость реакции и время протекания реакции до начала помутнения раствора обратно пропорциональны. Следовательно:
где v1 – скорость реакции в первом случае (v1 = 1); v2 – скорость реакции во втором (третьем) случае; τ1 – время протекания реакции до начала помутнения раствора в первом случае, с; τ2 – время протекания реакции до начала помутнения раствора во втором случае, с. Результаты опыта внесите в табл. 1.
Таблица 1.
Опыт 2 Зависимость скорости реакции от температуры. Зависимость скорости реакции от температуры изучают на примере реакции Nа2S2О3 + Н2S04 = Nа2SО4 + S02 + H2O + S По правилу Вант - Гоффа (при γ = 1,8) получаем, что при повышении температуры на 10° скорость реакции увеличится в 1,8 раза, на 20° - в 3,24 раза, на 30° - в 5,832 раза и т.д. Приведите бюретки с растворами Nа2S2О3, Н2S04 и водой в рабочее положение. В две пробирки из бюретки прилейте по 1 мл Н2S04. В две другие пробирки из бюреток прилейте по 1 мл раствора Nа2S2О3 и по 2 мл воды. Одну пару пробирок (одна пробирка с Н2S04, другая с 1 мл Nа2S2О3 и 2 мл воды) поместите в стакан с горячей водой с температурой на 10° выше комнатной. Через 5-7 мин, когда растворы нагреются до нужной температуры, смешайте их и определите время помутнения раствора, как в опыте 1. Другую пару пробирок поместите в термостат с температурой на 20о выше комнатной. Через 5-7 мин смешайте растворы и определите время начала помутнения. Рассчитайте vпракт для второго и третьего случаев (методика расчета дана выше). На миллиметровой бумаге постройте кривую зависимости vтеор от температуры. На этом же графике отметьте значения vпракт. Рассчитайте значение температурного коэффициента γпракт исходя из опытных данных. Результаты опыта запишите в табл. 2. (экспериментальные данные для комнатной температуры возьмите из опыта 1, № п/п 1).
Таблица 2.
Опыт 3 Влияние поверхности раздела реагирующих веществ на скорость реакции в гетерогенной системе (полумикрометод) а) Взаимодействие карбоната кальция с соляной кислотой. Приготовьте два небольших приблизительно одинаковых кусочка мела. Один из них разотрите пестиком на листе бумаги и пересыпьте в коническую пробирку, второй поместите в другую пробирку. В обе пробирки одновременно добавьте по 15-20 капель концентрированной соляной кислоты. Напишите уравнение реакции. Отметьте наблюдаемые явления и объясните их. Опыт 4 Зависимость скорости реакции от природы реагирующих веществ. В две пробирки поместите примерно одинаковые промытые водой кусочки цинка. В первую пробирку прилейте 0,1 М раствора HCI, в другую 0,1 М раствора уксусной кислоты. Отметьте, в какой из пробирок газ выделяется более интенсивно. Чем объяснить различную скорость выделения водорода в первом и во втором случаях? Напишите уравнения реакций взаимодействия цинка с уксусной и соляной кислотами. ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1 Вычисление скорости реакции по концентрациям реагирующих веществ. Реакция между веществами А и В протекает по уравнению 2А + В = С; концентрация вещества А равна 6 моль/л, а вещества В - 5 моль/л. Константа скорости реакции равна 0,5 л2∙моль -2∙с-1. Вычислите скорость химической реакции в начальный момент и в тот момент, когда в реакционной смеси останется 45 % вещества В. Решение Согласно закону действующих масс скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Следовательно, для
Скорость химической реакции в начальный момент равна v = 0,5∙ 6 2 ∙5 = 90,0 моль ∙с -1∙ л -1 По истечении некоторого времени в реакционной смеси останется 45 % вещества В. т. е. концентрация вещества В станет равной 5,0∙0,45= 2,25 моль/л. Значит, концентрация вещества В уменьшилась на 5,0 - 2,25 = 2,75 моль/л. Так как вещества А и В взаимодействуют между собой в соотношении 2:1, то концентрация вещества А уменьшилась на 5,5 моль/л (2,75∙ 2) и стала равной 0,5 моль/л (6,0 - 5,5). Следовательно, v2 = 0,5∙(0.5)2 ∙ 2,25 = 0,28 моль∙с -1∙л -1. Пример 2 Как изменится скорость прямой реакции 2СО + О2 = 2СО2 если общее давление в системе увеличить в 4 раза? Решение Увеличение давления в системе в 4 раза вызовет уменьшение объема системы в 4 раза, а концентрация реагирующих веществ возрастет в 4 раза. Согласно закону действующих масс начальная скорость реакции равна
после увеличения давления
После увеличения давления в 4 раза скорость реакции возросла в 64 раза.
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ
1. Знать понятия: скорость химической реакции, катализ и катализатор, константа скорости химической реакции, энергия активации, порядок реакции. 2. Знать факторы, влияющие на скорость химической реакции. 3. Уметь выражать связь между скоростью реакции и концентраций реагирующих веществ на основе закона действующих масс. 4.Знать правило Вант - Гоффа, уметь применять его для нахождения скорости химической реакции при повышении температуры на определенное число градусов. ЗАДАЧИ ДЛЯ САМОКОНТРОЛЯ 1. Что называют скоростью химической реакции? От каких факторов она зависит? 2. Как и почему изменяется скорость химической реакции при изменении температуры? 3. Что называют энергией активации? 4. От каких факторов зависит скорость химической реакции в гетерогенных системах? 5. Что называют катализатором? Какое влияние и почему оказывает катализатор на скорость химической реакции? 6. Что называют порядком реакции? Запишите кинетическое уравнение для реакции первого порядка. 7. Изобразите графически зависимость IgC от t для реакции первого порядка. 8. Константа скорости реакции А + 2В = ЗС равна 0,6 л2∙ моль -2∙с -1. В результате реакции концентрация вещества В оказалось равной 0,5 моль/л. Вычислите, какова концентрация вещества А и скорость прямой реакции? 9. На сколько градусов нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7.
ЛИТЕРАТУРА
1. Коровин Н.В. Общая химия.-М.: Высш.шк., 2000.-С. 167-203. 2. Романцева Л.М., Лещинская З.Л, Суханова В.А. Сборник задач и упражнений по общей химии - М.: Высш. шк., 19991.-с. 74-91. Лабораторная работа №6 Химическое равновесие
Цель работы: изучение влияния различных факторов на химическое равновесие. Оборудование и реактивы: разбавленные растворы хлорида железа (III) и роданида аммония в бюретках, концентрированный раствор FeCI3, твердый хлорид аммония и роданид аммония, нитрат свинца (II), штатив и 4 пробирки, U -образная трубка, пробки с газоотводными трубками, спиртовка, два химических стакана, лед, электрическая плитка.
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Понятие «химическое равновесие» применимо только к обратимым реакциям. Химическим равновесием называют такое состояние реагирующей системы, при котором скорость прямой реакции vпрям. равна скорости обратной реакции vобрат.. Равенство скоростей прямой и обратной реакций является кинетическим условием химического равновесия. Химическое равновесие характеризуется постоянным для данных условий соотношением равновесных концентраций всех веществ, участвующих во взаимодействии. Величина, равная отношению произведения равновесных концентраций Н2(г) +I2(г) = 2HI(г) константа равновесия имеет вид:
Константа равновесия зависит от природы реагентов, температуры и не зависит от исходной концентрации веществ в системе. Химическое равновесие остается неизменным до тех пор, пока постоянны параметры, при которых оно установилось. При изменении условий равновесие нарушается. Через некоторое время в системе вновь наступает равновесие, характеризующееся новым равенством скоростей и новыми равновесными концентрациями всех веществ. Равновесие смещается в ту или иную сторону потому, что изменение условий по-разному влияет на скорости прямой и обратной реакций. Равновесие смещается в сторону той реакции, скорость которой при нарушении равновесия становится больше. Например, если при изменении внешних условий равновесие нарушается так, что скорость прямой реакции становится больше скорости обратной реакции, то равновесие смещается вправо. В общем случае направление смещения равновесия определяется принципом Ле-Шателье: если на систему, находящуюся в равновесии, оказывать внешнее воздействие, то равновесие смещается в том направлении, которое ослабляет эффект внешнего воздействия.
МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТОВ
Опыт 1 Влияние концентрации веществ на химическое равновесие.
В данном опыте изучают обратимую реакцию взаимодействия хлорида железа (III) с роданидом аммония. Роданид железа Fe(NCS)3 придает раствору красную окраску. По изменению интенсивности окраски можно судить об изменении концентрации Fe(NCS)3 т.е. о смещении равновесия в ту или иную сторону. В четыре пробирки внесите по 5-10 капель разбавленных растворов хлорида железа (III) FeCI3 и роданида аммония NH4CNS. Легким встряхиванием пробирок размешайте растворы. Поставьте все пробирки в штатив. В одну из пробирок добавьте несколько капель концентрированного раствора хлорида железа (III), в другую - несколько кристаллов роданида аммония, в третью - хлорида аммония, четвертую пробирку оставьте для сравнения. Растворы размешайте энергичным встряхиванием или стеклянной палочкой. При оформлении отчета отметьте изменение интенсивности окраски в каждом случае; запишите уравнение реакции между FeCI3 и NH4CNS и выражение константы равновесия данной реакции. В каком направлении смещается равновесие и как изменяется концентрация каждого компонента в случае добавления: а) хлорида железа (III); б) роданида аммония; в) хлорида аммония? Опыт 2 Влияние температуры на химическое равновесие.
В данном опыте изучают реакцию димеризации диоксида азота: 2NO2 = N2O4 NO2 - очень опасное вещество. (Опыт проводить в вытяжном шкафу!). По изменению окраски газовой смеси можно судить о концентрации ее компонентов, т.е. о смещении равновесия в сторону прямой или обратной реакции. U -образную трубку, с двумя хорошо подобранными резиновыми пробками наполните диоксидом азота, который получите разложением нитрата свинца. Реакция протекает по уравнению 2Pb(N03)2 = 2РЬО + 4NO2 + О2 Оба конца U -образной трубки плотно закройте резиновыми пробками и, перевернув ее концами вниз, поместите одно колено трубки в стакан с горячей водой, другой в стакан с ледяной водой (холодную и горячую воду приготовьте заранее). Наблюдайте изменение окраски в том и другом колене U -образной трубки. Выньте трубку из стаканов, и то колено, которое было в холодной воде, опустите в горячую воду, а колено из горячей воды - в холодную. Наблюдайте вновь изменение окраски в каждом колене. В каком направлении происходит смещение равновесия данной реакции при нагревании и охлаждении? Объясните смещение химического равновесия. Результаты наблюдений и выводов запишите в табл. 1.
Таблица 1.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1 Вычисление константы равновесия реакции по равновесным концентрациям реагирующих веществ и определение их исходных концентраций.
При синтезе аммиака N2 +3H2 = 2NH3 равновесие установилось при следующих концентрациях реагирующих веществ (моль/л):
Решение
Определяем константу равновесия Кс этой реакции:
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль NH3, расходуется 1 моль азота, а на образование 3,6 моль аммиака потребовалось 3,6/2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим его первоначальную концентрацию: Сисх(Н2) = 2,5 + 1,8 = 4,3 моль/л | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
| Поделиться: |


 K4[Fe(CN)6] 4 K+ + [Fe(CN)6] 4-.
K4[Fe(CN)6] 4 K+ + [Fe(CN)6] 4-. где
где  — скорость химической реакции;
— скорость химической реакции;  — константа скорости;
— константа скорости;  и
и  концентрации реагирующих веществ.
концентрации реагирующих веществ. где
где  - концентрация кислорода; S - площадь поверхности раздела между фазами.
- концентрация кислорода; S - площадь поверхности раздела между фазами.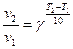
 - температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.
- температурный коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10 оС.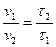




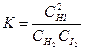
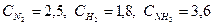 . Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.
. Рассчитайте константу равновесии этой реакции и исходные концентрации азота н водорода.



