
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение молярной массы эквивалента цинкаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Цель работы: познакомиться с понятием химического эквивалента, определить молярную массу химического эквивалента цинка методом вытеснения водорода. Оборудование и реактивы: прибор для определения молярной массы эквивалента металла (см. рис. 1), термометр, барометр, 25%-ный раствор соляной кислоты, металлический цинк. ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ Химическим эквивалентом (Э) называется реальная или условная частица вещества, которая может замещать, присоединять, высвобождать или быть каким-либо другим способом эквивалентна (равноценна) одному иону водорода в кислотно-основных и обменных реакциях, либо одному электрону в окислительно-восстановительных реакциях. Реальные частицы - это атомы, ионы, молекулы и т.д., а условные частицы - это, например, 1/2 (H2SO4), 1/4(С), 1/3(Fe3+). В общем случае эквивалент любого вещества X может быть записан в виде ЭХ =1/z(X), где z - число эквивалентности, или эквивалентное число, которое всегда > 1. Оно показывает, сколько эквивалентов содержится в одной формульной единице вещества. Для данного вещества z находится по конкретной реакции. В окислительно-восстановительных процессах z определяется числом электронов, принятых или отданных одной формульной единицей вещества, например, в реакции: Mg + 2HCl → MgCl2 + H2 Z(Mg)=2, т.к. магний в ходе окислительно-восстановительной реакции отдает 2 электрона, а ЭMg =½ (Mg). В обменных процессах Z определяется стехиометрией и равно знаменателю правильной дроби, которая получается при делении коэффициента перед веществом на самый большой коэффициент в реакции: АI2O3 + 6HCI =2AICI3 +3H2O Z (АI2O3) = 6, т.к. при делении коэффициента перед АI2O3 на самый большой коэффициент в реакции - 6, получается правильная дробь Когда речь не идет о конкретной реакции, при определении z для сложных веществ можно воспользоваться следующими правилами: 1) для оксидов z равно числу атомов элемента, умноженному на степень окисления элемента; 2) для кислот z равно основности кислоты; 3) для оснований z равно кислотности основания; 4) для солей z равно числу катионов металла, умноженному на заряд катиона. Количество вещества эквивалента обозначается vЭ,единица измерения - моль. Один моль эквивалента вещества содержит 6,022-1023 эквивалентов. Молярная масса эквивалента MЭ - это масса 1 моль эквивалентов вещества, измеряется в г/моль. Связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества выражается соотношениями:
Экспериментальное определение молярной массы химического эквивалента цинка в данной работе основано на законе эквивалентов: Вещества реагируют друг с другом в равных количествах эквивалентов Из закона эквивалентов следует, что массы реагирующих друг с другом веществ, а также массы продуктов реакции относятся друг к другу как молярные массы их эквивалентов:
Если вещество находится в газообразном состоянии то для него справедливы соотношения: МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТА Устройство прибора для определения молярной массы эквивалента металла представлено на рис.1. Бюретка (1) емкостью 50 мл соединена резиновыми трубками с воронкой (2) и пробиркой (3). В бюретку наливают воду, которая должна также заполнять часть воронки. Перед началом опыта необходимо убедиться в герметичности прибора. Для этого, пустую пробирку соединяют с бюреткой, и поднимают воронку так, чтобы уровень воды в ней был выше, чем в бюретке. При этом в приборе создается давление, превышающее атмосферное. Если уровень воды в бюретке не изменяется после незначительного первоначального повышения, то прибор герметичен и готов к работе. В противном случае следует исправить дефекты, допущенные при сборке прибора. При проведении опыта следует придерживаться следующей последовательности действий: 1. Влить в пробирку на 1/5 ее объема через воронку соляную кислоту. Стенки пробирки при этом должны остаться сухими.
 
Рис.1. Прибор для определения молярной массы эквивалента металла
2. Держа пробирку в наклонном положении, положить на ее стенку кусочек цинка, взвешенный в лабораторной работе №1 так, чтобы он не соприкасался с кислотой. 3. Присоединить пробирку к прибору, плотно закрыв ее пробкой. Убедиться, что герметичность прибора не нарушена. 4. Передвижением воронки привести воду в ней и бюретке к одному уровню. Отметить и записать уровень воды в бюретке V1, произведя отсчет по нижнему краю мениска (утолщенная поверхностная пленка воды в бюретке). Мениск должен находиться на уровне глаз. 5. Стряхнуть цинк в кислоту. По окончании реакции дать пробирке остыть до комнатной температуры, после чего снова привести воду в бюретке и воронке к одному уровню. Отметить и записать уровень воды в бюретке V2. Разность V1 - V2 равна объему выделившегося водорода в реакции: Zn + 2 HCl = ZnCl2 + H2 ↑ 6. Отметить показания термометра и барометра. 7. Результаты опыта занести в табл. 1.
Таблица 1. Результаты опыта.
ОБРАБОТКА РЕЗУЛЬТАТОВ ОПЫТА 1. По разности уровней воды в бюретке до и после протекания реакции вычислить объем выделившегося водорода при температуре и давлении опыта. 2. Так как водород собирается над водой, то он насыщен водяным паром. Общее давление в приборе равно атмосферному и складывается из парциальных давлений водяного пара и водорода. Чтобы вычислить парциальное давление водорода, нужно из атмосферного давления Р вычесть величину давления насыщенного при температуре опыта водяного пара h. Для нахождения h следует воспользоваться данными табл.2. P(H2)=P-h Таблица 2. Давление насыщенного водяного пара при различных температурах.
3. Привести объем выделившегося водорода к нормальным условиям (Р0 -760 мм рт.ст., Т0 = 273 К), используя объединенное уравнение газового состояния:
4. Рассчитать экспериментальное значение молярной массы эквивалента цинка в г/моль по закону эквивалентов в соответствии с формулой:
где VЭ(H2) - объем, занимаемый одним моль эквивалента газообразного водорода, равный половине молярного объема водорода, т.е. 11,2 л/моль или 11200 мл/моль. 5. Рассчитать теоретическое значение молярной массы эквивалента цинка, зная молярную массу цинка и эквивалентное число z, численно равное числу электронов, отданных цинком в ходе окислительно-восстановительной реакции с соляной кислотой.
6. Вычислить относительную ошибку опыта по формуле:
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ Пример 1 На восстановление 7,09 г оксида двухвалентного металла требуется 2,24 л водорода, измеренного при (н.у.). Вычислить молярные массы металла и оксида. Чему равна относительная масса металла? Решение: По закону эквивалентов массы веществ m1 и m2, вступающих в реакцию, пропорциональны молярным массам их эквивалентов
Если одно из веществ находится в газообразном состоянии, то как правило, его количество измеряется в объемных единицах (см3, л, м3). Формулу (2) преобразуем относительно объема водорода:
Находим молярную массу эквивалента металла:
По закону эквивалентов:
Относительную атомную массу металла определяем из соотношения:
Пример 2 Определить молярную массу эквивалента Fe2(SO4)3 в реакции ионного обмена: Fe2(SO4)3 + 6NaOH = 2 Fe(OH)3 + 3 Na2SO4. Решение: По стехиометрии реакции Z частицы Fe2(SO4)3 равно 6, т. к. при делении коэффициента перед Fe2(SO4)3 получается правильная дробь МЭ(Fe2(S04)3) = M(Fe2(SO4)3) /6 = 400/6 = 66,7 (г/моль). НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ 1. Знать понятия: эквивалент, число эквивалентности, количество вещества эквивалента, молярная масса эквивалента. 2. Уметь выражать связь между молярной массой эквивалента, количеством вещества эквивалента, массой и молярной массой вещества. 3. Знать закон эквивалентов, уметь применять его для нахождения масс и молярных масс веществ, участвующих или образующихся в реакции. 4. Уметь определять молярную массу эквивалента элемента, эквивалент и молярную массу эквивалента вещества в реакции. ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ 1. Когда количество вещества эквивалента равно количеству вещества? 2. Определить молярную массу эквивалента Fe(OH)2Cl в реакциях: a) Fe(OH)2Cl + NaOH = Fe(OH)3 + NaCl; 6) Fe(OH)2Cl + 2HCl = FeCl3 + 2 H2O. 3. Почему молярная масса элемента постоянна, а молярная масса его эквивалента может изменяться? 4. Может ли молярная масса эквивалента элемента или вещества быть больше его молярной массы и почему? 5. Почему при расчетах масс реагентов по молярным массам их эквивалентов не нужно знать значения коэффициентов в уравнении реакции? 6. Найти массу алюминия, если при его полном растворении в кислоте выделяется такое же количество водорода, что и при растворении 1,752 г цинка. Молярная масса эквивалента цинка равна 32,69 г/моль, молярная масса эквивалента алюминия - 8,99 г/моль. 7. Для нейтрализации кислоты гидроксидом калия на ее 1,866 г потребовалось 15 г гидроксида калия, молярная масса эквивалента которого равна 56 г/моль. Вычислите молярную массу эквивалента кислоты. ЛИТЕРАТУРА 1. Курс общей химии./Под ред. Н.В.Коровина. - М.:Высш. шк., 1990. -С. 147. 2. Л.М.Романцева, З.Л.Лещинская, В.А.Суханова. Сборник задач и упражнений по общей химии. - М.:Высш. шк., 1991. - С.44 - 47.
Лабораторная работа № 3
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-19; просмотров: 2517; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.63.214 (0.013 с.) |

 , знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.
, знаменатель которой равен 6; Z(HCI) = 1, т.к. при делении коэффициента перед HCI на самый большой коэффициент в реакции - 6, получается 1.

 .
.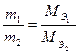
 ;
;  ; где
; где  – количество вещества эквивалента; V – объем газообразного вещества в данных условиях;
– количество вещества эквивалента; V – объем газообразного вещества в данных условиях;  – молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.
– молярный объем эквивалента вещества в тех же условиях; VM – молярный объем вещества; Z – число эквивалентности.
 2
2








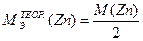
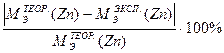
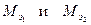
 ; (1)
; (1) (2)
(2)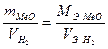
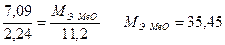


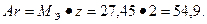
 , то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле
, то молярная масса эквивалента сульфата железа (Ш) в данной реакции может быть вычислена по формуле


