
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Расчет молярной массы эквивалента в окислительно-восстановительных процессахСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте Ранее мы уже говорили о том, что в ОВР эквивалентное число z равно числу электронов, которое принимает одна формульная единица окислителя или отдает одна формульная единица восстановителя: Пример 3: Укажите число электронов в окислительных и восстановительных процессах и рассчитайте молярную массу эквивалента окислителя и восстановителя: a) N+5 + xē = N–3; б) H2S – xē = S + 2H+. Решение: а) Число электронов, участвующих в процессе, можно найти по разности зарядов левой и правой части уравнения. В нашем случае число электронов равно n(ē) = 5 – (–3) = 8, и уравнение восстановления азота имеет вид: N+5 + 8ē = N–3. Окислителем является азот N, его молярная масса равна М(N) = 14 г/моль. Эквивалентное число равно числу электронов z(N) = 8. Таким образом, молярная масса эквивалента азота в данном процессе составляет: М(1/8 N) == = 1.8 г/моль. б) Число электронов, участвующих в процессе, равно n(ē) = 0 – 2 = –2 (полученный знак “–“ говорит о том, что в данном процессе идет отдача электронов): H2S – 2ē = S + 2H+. Восстановителем является соединение H2S. Его молярная масса равна М(H2S) = 34 г/моль, эквивалентное число равно z(H2S) = 2. Таким образом, молярная масса эквивалента восстановителя H2S составляет: М(1/2 H2S) == = 17 г/моль. Ответ: а) 8 электронов, 1.8 г/моль; б) 2 электрона, 17 г/моль.
35. Понятие об электродном потенциале. Гальванические элементы. ПОНЯТИЕ ОБ ЭЛЕКТРОДНОМ ПОТЕНЦИАЛЕВзаимные превращения электрической и химической форм энергии мож- но разделить на два типа: – процессы превращения химической энергии в электрическую (происходят в гальванических и топливных элементах, при разряде аккумуляторов); – процессы превращения электрической энергии в химическую (электролиз, заряд аккумуляторов). Системы, в которых протекают эти реакции, называются электрохимическими. Любая электрохимическая система состоит из двух электродов (проводник 1-го рода) и ионного проводника между ними (проводник 2-го рода). В электрохимической системе возникает контакт проводящих фаз различной химической природы и типа проводимости, которые характеризуются скачками потенциала. Скачки потенциала наблюдаются на границе металл – раствор электролита, раствор – раствор электролита (диффузионный потенциал), металл – металл (контактный потенциал). При погружении металла в водный раствор электролита происходит взаимодействие поверхностных ионов металла с молекулами воды. В результате этого, гидратированные ионы металла переходят в раствор, оставляя в металле электроны: Me + mH2O ↔ Me(H2O)n+m + nē. Электростатическое взаимодействие между отрицательно заряженной поверхностью металла и катионами раствора препятствует бесконечному переходу ионов в одном направлении. В итоге, в системе металл – раствор электролита устанавливается подвижное равновесие, а на границе раздела фаз возникает двойной электрический слой. Количественно электродное равновесие металла со своими ионами рассчитывается по уравнению Нернста: EEeMRn FTln neM/0eMn eM/00=+Mena, где EMen+/Me0 – равновесный электродный потенциал металла, В;21 E0Men+/Me0 – стандартный электродный потенциал металла в растворе соли с активностью ионов равной 1 моль/л. Величины стандартных электродных потенциалов металлов по отношению к водородному электроду, принятому за эталон (E02H+ H2 = 0В), приведены в приложении (табл. 2); aMen+ – активность ионов металла в растворе, моль/л; n – за ря дность ионов; R – у нив ерсальная газовая постоянная, равная 8,31 Дж·моль–1·К–1; Т – термодинамическая температура, К; F – по ст оянная Фарадея, равная 96485 Кл/моль. Один фарадей электричества необходим для превращения одного моль вещества на электроде. Постоянную Фарадея можно рассчитать исходя из того, что 1 моль вещества несет 6,02·1023 элементарных зарядов (постоянная Авогадро), а один элементарный заряд равен 1,60·10–19Кл. Активность ионов (ai) связана с концентрацией через коэффициент активности (γi), величина которого зависит от ионной силы раствора (Im): Im = ∑ i i2 ai = ciγi; где ic – концентрация иона, моль/л; i n– зарядность иона. Значения коэффициентов активности ионов при различной ионной силе раствора приведены в табл. 3 приложения. Подставляя в уравнение Нернста (12) соответствующие значения констант при стандартных условиях, имеем: +++EEeM0, 0n59lg neM/0e MneM/00=+Mena. Некоторые металлы (Au, Pt) обладают столь прочной кристаллической решеткой, что катионы из нее не могут освободиться. Измеренный равновесный потенциал для таких металлов не совпадает с табличным, поскольку на поверхности этих металлов могут адсорбироваться вещества из раствора электролита, которые образуют собственные электрохимические системы, находящиеся в равновесии с раствором. Электроды в таком случае называются инертными, а потенциал определяется равновесием между ионами (молекулами), адсорбированными на электроде и молекулами (ионами) раствора электролита. Подобный механизм наблюдается в работе водородного (Pt, H2│2H+), хлорного (Pt, Cl2│2Cl–) электродов. Существуют системы, в которых и окисленная и восстановленная формы находятся в растворе: при этом происходит обмен электронами между инерт ным электродом и ионами раствора. Примером служит редоксэлектроды (окислительно-восстановительные), Fe2+, Fe3+│Pt; Sn2+, Sn4+│Pt. 3. ГАЛЬВАНИЧЕСКИЕ ЭЛЕМЕНТЫ Гальваническим элементом (ГЭ) называется система, в которой энергия химической реакции преобразуется в электрическую энергию. Рассмотрим процессы, протекающие при работе гальванического элемента Даниэля – Якоби (медно-цинкового). Схема гальванического элемента: Zn│ZnSO4││CuSO4│Cu. Стандартный электродный потенциал цинка равен –0,76 В (см. приложение, табл. 2), а потенциал меди равен +0,34 В. При замыкании разнородных электродов: цинк, имея меньшее значение электродного потенциала, выступает в качестве анода (восстановитель). На нём протекает реакция окисления. Медный электрод, с большим по сравнению с цинком потенциалом, является катодом (окислителем). На нём восстанавливаются ионы меди из раствора соли: Zn – 2ē → Zn2+ – анодное окисление; Cu2+ + 2ē → Cu0 – катодное восстановление; Zn + Cu2+ → Zn2+ + Cu0 – токообразующая реакция. Электроны от цинка по внешней цепи перемещаются к медному электроду, где участвуют в процессе восстановления, движение ионов в растворе соли замыкает электрическую цепь. Для предотвращения смешивания растворов солей используют электролитический мостик или пористую перегородку (цепи «с переносом»). У поверхности соприкосновения растворов, вследствие неодинаковой подвижности ионов, возникает «диффузионный потенциал». Чтобы свести его влияние к минимуму, в качестве наполнителя в электролитическом мостике используют электролит, катионы и анионы которого, имеют близкие значения подвижностей (KCl или NH4NO3). В некоторых случаях оба электрода погружены в один и тот же раствор электролита (цепи «без переноса»). Диффузионный потенциал в этом случае полностью отсутствует. Работу гальванического элемента можно оценить величиной его электродвижущей силы (Е). ЭДС равна максимальной разности потенциалов катода и анода: E = Eкатода – Eанода. Различают гальванические элементы химические, у которых ЭДС возникает вследствие различной химической природы электродов, и концентрационные, составленные из двух, качественно одинаковых, полуэлементов, различающихся активностью потенциалобразующих ионов. В последних ЭДС возникает за счет выравнивания концентраций в приэлектродных пространствах. Примером концентрационного ГЭ может служить система, состоящая из двух серебряных электродов, погруженных в растворы собственных солей с различной активностью ионов серебра: Ag│Ag+(c1)││Ag+(c2)│Ag, где c2 > c1. Как видно, в концентрационном элементе химическая реакция не протекает, и стандартная ЭДС его равна нулю. Уравнение Нернста для расчета ЭДС концентрационного элемента имеет вид:.По определению, гальванический элемент является первичным источником тока и характеризуется ЭДС, напряжением, ёмкостью и энергией, которую он может отдать во внешнюю цепь за время своей работы. При работе напряжение гальванического элемента меньше его ЭДС из-за поляризации электродов и омических потерь в проводниках 1-го и 2-го рода: U = E – ∆E – I(r1+r2), где E– ЭДС элемента, В; ∆E – поляризация катода и анода, В (см. главу «Электролиз»); I – с ил а тока, А; 1, rr2 – сопротивление проводников первого и второго рода, Ом. По мере работы (разряда) элемента уменьшается концентрация реагентов и снижается ЭДС. Кроме того, возрастает поляризация элемента. Таким образом, при работе гальванического элемента напряжение его постепенно падает. Задачей разработчиков ГЭ является создание таких элементов, у которых напряжение в ходе его эксплуатации уменьшалось бы незначительно. Постоянное напряжение ГЭ, как и любого другого химического источника тока, вытекает из удобства использования его на практике. Ёмкость элемента – это количество электричества, которое источник тока отдаёт при разряде. Она определяется количеством реагентов и степенью их превращения. Если элемент разряжается при постоянном внешнем сопротивлении (R), то ёмкость рассчитывается по уравнению где τ – время разряда, ч; СR – ёмкость элемента, А·ч; I – си ла тока, А; U – н апряжение элемента, В. Энергия элемента (W) определяется: – если элемент разряжается при постоянном нешнем сопротивлении (R), то – если элемент разряжается при постоянной силе тока (I), то: Важной характеристикой элемента служит удельная энергия, т. е. рассчитанная на единицу активной массы. Более высокую удельную энергию можно получить с использованием элементов с большим значением ЭДС, малой поляризацией и высокими степенями превращения реагентов (Zn│MnO2, Mg│CuO и др.). Методы исследования, в основе которых лежат термодинамические соотношения между ЭДС электрохимических цепей с одной стороны и физикохимическими параметрами растворов с другой, называются потенциометрическими. Их используют для определения водородного показателя раствора (рН), ионного произведения воды, константы гидролиза солей, константы диссоциации кислоты и основания, растворимости малорастворимых солей. Цепь составляют таким образом, чтобы один из электродов был с из-вестным значением потенциала, величина которого не изменяется в ходе исследования. Такие электроды называют электродами сравнения. Часто в качестве электродов сравнения используют хлоридсеребряный (Ag, AgCl│KCl) и каломельный (Hg, Hg2Cl2│KCl) электроды. Они отличаются хорошей воспроизводимостью результатов, надежны и просты в использовании.
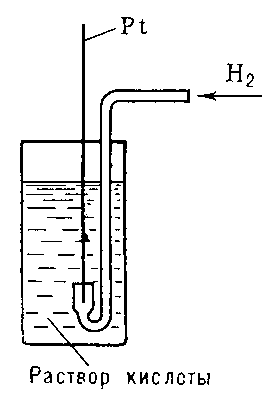
36. Измерение электродных потенциалов. Стандартный водородный электрод и водородная шкала потенциалов. Вычисление электродных потенциалов Электродный потенциал не может быть получен эмпирически. Потенциал гальванической ячейки вытекает из «пары» электродов. Таким образом, невозможно определить величину для каждого электрода в паре, используя эмпирически полученный потенциал гальванической ячейки. Для этого установлен стандартный водородный электрод, для которого этот потенциал точно определён и равен 0,00 В, и любой электрод, для которого электронный потенциал ещё неизвестен, может быть соотнесён со стандартным водородным электродом с образованием гальванической ячейки — и в этом случае потенциал гальванической ячейки даёт потенциал неизвестного электрода.Так как электродные потенциалы традиционно определяют как восстановительные потенциалы, знак окисляющегося металлического электрода должен быть изменён на противоположный при подсчёте общего потенциала ячейки. Также нужно иметь в виду, что потенциалы не зависят от количества передаваемых электронов в полуреакциях (даже если оно различно), так как они рассчитаны на 1 моль переданных электронов. Отсюда при расчёте какого-либо электродного потенциала на основании двух других следует проявлять внимательность. Например: Fe3+ + 3e− → Fe(тв) −0.036 В Fe2+ + 2e− → Fe(тв) −0.44 В Для получения третьего уравнения:Fe3+ + e− → Fe2+ (+0.77 В)следует умножить потенциал первого уравнения на 3, перевернуть второе уравнение(поменять знак) и умножить его потенциал на 2. Сложение этих двух потенциалов даст стандартный потенциал третьего уравнения.Водородный электрод платиновая пластинка, электролитически покрытая платиновой чернью, погружённая в раствор кислоты с определённой концентрацией ионов водорода Н+ и омываемая током газообразного водорода. Потенциал В. э. возникает за счёт обратимо протекающей реакции Между водородом, адсорбированным платиновой чернью, и ионами водорода в растворе устанавливается равновесие. Потенциал электрода Е определяется уравнением Нернста:
В. э. применяют как электрод сравнения
Рисунок к ст. Водородный электрод. 37. Сущность электролиза. Анодное окисление и катодное восстановление. Электролиз - основной метод промышленного производства алюминия, хлора и едкого натра, важнейший способ получения фтора, щелочных и щелочноземельных металлов, эффективный метод рафинирования металлов. В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т.п., так называемые вторичные процессы Для осуществления электролиза к отрицательному полюсу внешнего источника постоянного тока присоединяют катод, а к положительному полюсу - анод, после чего погружают их в электролизер с раствором или расплавом электролита В результате электролиза на электродах (катоде и аноде) выделяются соответствующие продукты восстановления и окисления, которые в зависимости от условий могут вступать в реакции с растворителем, материалом электрода и т.п., так называемые вторичные процессыАнодное окисление и катодное восстановление.В электролизере, схема которого показана на рис. 1, на положительномэлектроде — аноде ионы отдают электроны, т. е. протекает реакцияэлектрохимического окисления; на отрицательном электроде — катоде происходит присоединение электронов, т. е. протекает реакция восстановления.
Рис. 1. Схема электролизера: 1 — корпус; 2 — анод; 3 — катод; 4 — диафрагма Эти процессы разработаны для очистки сточных вод от растворенных примесей (цианидов, роданидов, аминов, спиртов. альдегидов, нитросоединений,азокрасителей, сульфидов, меркаптанов и др.). В процессах электрохимическогоокисления вещества, находящиеся в сточных водах, полностью распадаются с образованием СОз, МНз и воды или образуются более простые и нетоксичные вещества, которые можно удалять другими методами.В качестве анодов используют различные электролитически нерастворимыематериалы: графит, магнетит, диоксиды свинца, марганца и рутения, которые наносят на титановую основу. Катоды изготовляют из молибдена, сплава вольфрама с железом или никелем, из графита, нержавеющей стали и других металлов, покрытых молибденом, вольфрамом или их сплавами. Процесс проводят в электролизерах с диафрагмой и без нее. Кроме основных процессов электроокисления и восстановления, одновременно могут протекать электрофлотация, электрофорез и электрокоагуляция. Сточные воды, содержащие цианиды, образуются на предприятиях машиностроения, приборостроения, черной и цветной металлургии, химической промышленности и др. В состав вод кроме простых цианидов (KCN, NaCN) входят комплексные цианиды цинка, меди, железа и других металлов, концентрация которых колеблется от 10 до 600 мг/л. Обычно рН таких стоков колеблется в пределах 8—12. Анодное окисление цианидов протекает по реакциям Окисление может быть проведено и с образованием азота: Разрушение цианидов происходит в результате электрохимического окисления на аноде и окисления хлором, выделяющимся на аноде в результате разложения NaCl.
38. Электролитическое получение металлов. Электролиз расплавов. Аккумуляторы. Различают электролиз расплавов и растворов электролитов. АККУМУЛЯТОРЫ электрические (от лат. accumulator- собиратель, накопитель), хим. источники тока многократного действия. При заряде от внеш. источника электрич. тока в аккумуляторе накапливается энергия, к-рая при разряде вследствие хим. р-ции непосредственно превращ. снова в электрическую и выделяется во внеш. цепь. По принципу работы и осн. элементам конструкции аккумуляторы не отличаются от гальванических элементов, но электродные р-ции, а также суммарная токообразующая р-ция в аккумуляторах обратимы. Поэтому после разряда аккумулятора может быть снова заряжен пропусканием тока в обратном направлении: на положит. электроде при этом образуется окислитель, на отрицательном-восстановитель. Наиб. распространены свинцовые аккумуляторы, часто наз. также кислотными. Их действие сновано на р-ции:
НРЦ 2,08 В. Осн. трудность при разработке: создание технологии изготовления тонких, но достаточно стойких деталей из твердого электролита. Разрабатывают также высокотемпературные сульфид-железо-литиевые аккумуляторы; в них вместо твердого электролита применяют расплав солей, окислителями служат FeS или FeS2. По своим характеристикам эти аккумуляторы близки к серно-натриевым. Если требуется более высокое напряжение, чем у отдельного аккумулятора, применяют аккумуляторные батареи, состоящие из последовательно включенных аккумуляторов, имеющих общий корпус, выводы и маркировку. Батареи широко применяют в транспортных ср-вах для запуска двигателей, освещения и др. Тяговые батареи используют для силовых установок электрокаров, стационарные большой емкости-для электропитания телефонных сетей, в кач-ве аварийных источников электроэнергии на случай перебоев в электросети (напр., в операционных). Малогабаритные герметичные батареи применяют для питания переносных радиоприемников и др. устройств. Большое внимание уделяется разработке батарей для электромобилей. Мировое произ-во одних лишь стартерных батарей из свинцовых аккумуляторов превышает 100 млн. штук в год. В отличие от гальванич. элементов аккумуляторы требуют ухода при эксплуатации: их необходимо заряжать, периодически доливать электролит и поддерживать постоянной его концентрацию, проводить тренировочные и контрольные зарядно-разрядные циклы и т.п. Разрабатывают т. наз. малообслуживаемые и необслуживаемые аккумуляторы, уход за которыми упрощен. 39. Основные виды коррозии. Классификация коррозионных процессов. Электрохимическая коррозия металлов. Корро́зия (от лат. corrosio — разъедание) — это самопроизвольное разрушение металлов в результате химического или физико-химического взаимодействия с окружающей средой. В общем случае это разрушение любого материала, будь то металл или керамика,дерево или полимер. Причиной коррозии служит термодинамическая неустойчивость конструкционных материалов к воздействию веществ, находящихся в контактирующей с ними среде. Пример — кислородная коррозия железа в воде: 4Fe + 6Н2О + ЗО2 = 4Fe(OH)3. Гидратированный оксид железа Fe(OН)3 и является тем, что называют ржавчиной. Классификация коррозионных процессов. Все многообразие коррозионных процессов принято классифицировать по признаку их механизма, условий протекания и характеру получаемого разрушения. По механизму протекания различают химическую и электрохимическую коррозию. По условиям протекания процессов, которые весьма разнообразны, различают следующие виды коррозии (основные виды): -Газовую коррозию - коррозию металлических материалов в атмосфере раскаленных газов; -Атмосферную коррозию - коррозию металлических материалов в атмосфере влагосодержащих газов; -Жидкостная коррозия - коррозию металлов в жидкостях (электролитах и не электролитах); -Подземную коррозию - коррозию в почвах и грунтах; -Структурную коррозию - коррозию металлических материалов в связи с неоднородностью их структуры; -Биокоррозию - коррозию под влиянием микроорганизмов; -Коррозию блуждающим и внешним током. По характеру коррозионного разрушения различают: -Общую коррозию (сплошную); -Местную коррозию (коррозию отдельных участков металлических поверхностей). Общая коррозия бывает равномерной (протекает с одинаковой скоростью на всей поверхности металла), например, коррозия углеродистой стали в H2SO4 ; неравномерной протекающей с неодинаковой скоростью на различных участках поверхности металла (например, коррозия углеродистой стали в морской воде); избирательной (разрушается лишь одна структурная составляющая сплава, например, ферритная структурная составляющая чугуна). Местная коррозия, бывает: пятнами (коррозия латуни в морской воде), язвами (коррозия стали в грунте), точечной (коррозия нержавеющей стали в морской воде), межкристаллитной (коррозия нержавеющей стали в кислых средах), ножевой (коррозия сварных швов).электрохимическая коррозия является наиболее распространенным типом коррозии металлов. По электрохимическому механизму корродируют металлы в контакте с растворами электролитов (морская вода, растворы кислот, щелочей, солей). В обычных атмосферных условиях и в земле металлы корродируют также по электрохимическому механизму, т.к. на их поверхности имеются капли влаги с растворенными компонентами воздуха и земли. Электрохимическая коррозия является гетерогенным и многостадийным процессом. Ее причиной является термодинамическая неустойчивость металлов в данной коррозионной среде.
40. Защита металлов от коррозии. Коррозии подвергается почти 1/3 вводимого в эксплуатацию металла. Часть его переплавляется и снгова возвращается в промышленность. Но всё-таки 10% от общей массы - теряется безвозвратно. Устранить ржавчину механическим способом практически невозможно. Поэтому часто применяют растворы, содержащие сильнодействующие химические реактивы - кислоты, основания и т.д. Вместе с устраненнием ржавчины достигается эффект предохранения поверхности от внешних возздействий.
|
||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 1150; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.198 с.) |





 Для повышения электропроводности сточных вод и снижения рас-хода энергии к водам добавляют NaCl. При концентрации CN" 1 г/л добавляют 20—30 г/л NaCl. В этом процессе используют графитовый анод и стальной катод. Оптимальные условия окисления: анодная плотность тока 3—4 А/дм2, меж-злектродно" пространство 3 см, скорость воды 30 дм3/ч, рН 8—9. Степень очистки приближается к 100%.
Для повышения электропроводности сточных вод и снижения рас-хода энергии к водам добавляют NaCl. При концентрации CN" 1 г/л добавляют 20—30 г/л NaCl. В этом процессе используют графитовый анод и стальной катод. Оптимальные условия окисления: анодная плотность тока 3—4 А/дм2, меж-злектродно" пространство 3 см, скорость воды 30 дм3/ч, рН 8—9. Степень очистки приближается к 100%.







 Катод (-) Анод (+)
Катод (-) Анод (+) Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2
Mg2+ + 2e- = Mg 2Cl- - 2e- = Cl2 



