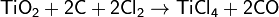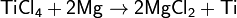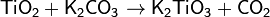Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нахождение металлов в природеСодержание книги Похожие статьи вашей тематики
Поиск на нашем сайте
Многие металлы широко распространены в природе. Так, содержание некоторых металлов в земной коре следующее: алюминия — 8,2% железа — 4,1% кальция — 4,1% натрия — 2,3% магния — 2,3% калия - 2,1 % титана — 0,56%
Большое количество натрия и магния содержится в морской воде: — 1,05%, — 0,12%. В природе металлы встречаются в различном виде: — в самородном состоянии: серебро, золото, платина, медь, иногда ртуть — в виде оксидов: магнетит Fe3O4, гематит Fe2О3 и др. — в виде смешанных оксидов: каолин Аl2O3 • 2SiO2 • 2Н2О, алунит (Na,K)2O • АlО3 • 2SiO2 и др. — различных солей: сульфидов: галенит PbS, киноварь НgS, хлоридов: сильвин КС1, галитNaCl, сильвинит КСl• NаСl, карналлит КСl • МgСl2 • 6Н2О, сульфатов: барит ВаSO4, ангидрид Са8О4 фосфатов: апатит Са3(РО4)2, карбонатов: мел, мрамор СаСО3, магнезит МgСО3. Многие металлы часто сопутствуют основным природным минералам: скандий входит в состав оловянных, вольфрамовых руд, кадмий — в качестве примеси в цинковые руды, ниобий и тантал — в оловянные. Железным рудам всегда сопутствуют марганец, никель, кобальт, молибден, титан, германий, ванадий. Распростронение металов Соединения элементов главной подгруппы II группы, за исключением бериллия и радия, широко распространены в природе. Кальций и магний относятся к числу наиболее распространенных элементов (кальция в земной коре содержится 3,4 %, а магния 2,0 %). Однако благодаря большой химической активности элементы щелочноземельной группы никогда не встречаются в свободном состоянии, а всегда в виде соединений. Карбонаты кальция и магния в виде известняка и мела (СаСО3), а также доломита (СаСО3∙МgСО3) образуют целые горные кряжи. Хотя и не в таких огромных массах, как только что названный двойной карбонат, поместами также в виде могцных залежей встречается простой карбонат магния МgСО3, магнезит, называемый также горьким шпатом, или тальковым шпатом. В Европе он находится главным образом в Штойермарко и на острове Эвбее, а из внеевропейских стран — в Калифорнии, Канаде и в китайской части Мав.чжурии. Местами встречается в больших количествах мрамор, состоящий почти из совершенно чистого карбоната кальция. Меньшее распространение имеют карбонаты тяжелых щелочноземельных металлов: стронцианит SrСO3 и витерит ВаСО3.
Мощные залежи образует гипс СаSO4∙2H2O (называемый также селенитом). Разновидностью его является алебастр. Безводный сульфат кальция СаSO4 — ангидрит — наряду с кизеритом МgSO4∙H2О является почти постоянным спутником каменной соли. Но н помимо этого, нередко встречаются слоистые залежи ангидрита. Из дцух сульфатов стронция и бария — целестина (SrSO4) и тяжелого шпата (ВаSO4) — особо широко распространен последний. Из силикатов магния следует указать оливин (Мg,Fе)2[SiO4], энстатит Мg2[Si2О6], а также содержащие воду силикаты — серпентин, асбест, тальк и морскую пенку. Чрезвычайный многообразием отличаются двойные силикаты магния и особенно кальция. К числу соединений кальция относятся следующие минералы: фосфорит, апатит 3Са3(РO4)2∙Са(F,С1)2 и плавиковый шпат (флюорит СаF2). Кроме того, следует еще упомянуть встречающуюся в небольших количествах, но довольно распространенную шпинель МgО∙Аl2О3, некоторые разновидности которой ценятся как драгоценные камни. В качестве продуктов выветривания минералов соединения кальция и магния всегда содержатся в почве, а также в большинстве природных вод, «жесткость» которых и обусловливается содержанием этих солей. В органической природе кальций и магний встречаются почти всюду: магний входит в качестве составной части в зеленое красящее вещество листьев (хлорофилл); кальций же в виде фосфата образует твердое вещество костей, а в виде апатита — еще более твердую часть зубной эмали. Яичная скорлупа, раковины и кораллы также состоят из карбоната кальция. Соли магния и кальция содержатся в довольно заметных количествах в морской воде. Последняя (кроме приблизительно 2,9 % хлоридов щелочных металлов) содержит в среднем около 0,3 % МgСl2, 0,04 % МgВr2, 0,18 % МgSO4 и 0,16 % СаSO4. Вода некоторых «горькосоленых» минеральных источников содержит значительные количества сульфата магния. Бериллий встречается в природе в виде некоторых минералов, не имеющих особенного распространения. Чаще всего из пих встречается берилл Ве3Al2[Si6O18], крупные месторождения которого известны в Бразилии, Северной Америке, Африке, Индии, Англии, Норвегии, Испании и на Урале. Некоторые содержащие бериллий минералы иногда встречаются в виде очень красивых экземпляров и считаются поэтому драгоценными камнями. Так, смарагд и аквамарин — разновидности берилла, а александрит — разновидность хризоберилла. Эвклаз и фенакит тоже считаются драгоценными камнями.
Радий в совершенно ничтожных количествах содержится в рудах урана, из которого он образуется путем радиоактивно го распада. Отношение радия к урану в этих рудах практически постоянно и равняется 1:3 000 000. Главный минерал, содержащий уран, — урановая смоляная руда — содержит в среднем 0,14 г радия на 1 т (1000 кг). Еще ничтожнее содержание радия в других урановых рудах, например в аутупите, карнотите и в других подобных минералах 44. Основные способы получения металлов. Металлы получают из руд, т.е. исходного сырья, в котором содержится экономически приемлемое количество металла. По мере истощения руд уменьшается экономически приемлемое содержание в них металла и повышается его стоимость. Предварительно руда обрабатывается для увеличения концентрации металла путем отделения пустой породы и разделения остатка на различные фракции. Последующие операции заключаются в получении соединения металла, из которого удобно выделить металл тем или иным способом. Так как большинство металлов в природе находится в окисленном состоянии, то извлечение их основано на восстановлении из тех или иных соединений в растворах при невысокой температуре) или расплавах (при повышенных температурах). Восстановление проводят химическими или электрохимическими способами. Химическое восстановление заключается во взаимодействии соединений металлов с углем, водородом или металлами-восстановителями. Например, при взаимодействии оксидов же-еза со специально обработанным углем (коксом) образуется чугун. J помощью водорода получают вольфрам, молибден, кобальт и ругие металлы, например, по реакции: WO3 + ЗН2 = W + ЗН2О Многие металлы производят взаимодействием соединений ме-ллов с другими металлами, например: BeF2 + Mg = Be + MgF2 Таким способом получают кадмий, олово, хром, серебро, титан И другие металлы. Кроме магния восстановителями обычно служат Цинк и алюминий. Электролизом из растворов осаждают медь, ни-Ксль, серебро, хром, кадмий, индий, олово и другие металлы. Элек-1ролизом из расплавов осаждаются сильные восстановители, такие, Как щелочные металлы, магний и алюминий. Получение чистых металлов. Свойства металлов зависят от содержания в них примесей. Например, титан долгое время не находил применения из-за хрупкости, обусловленной наличием примесей. После освоения методов очистки области применения титана резко расширились. Содержание лишь 0,03 % (масс, ноли) мышьяка приводит к снижению электрической проводимости меди на 14%. Особенно большое значение имеет чистота материалов в электронной и вычислительной технике и ядерной энергетике. В зависимости от суммарной атомной доли примесей (от 10'1 до 10~10%) различают 10 классов чистоты веществ. Если те или иные примеси особенно нежелательны для данной области применения материала, то оговаривают допустимое содержание этих примесей. Например, атомная доля бора, гафния и кадмия в материалах атомной энергетики не должна превышать 10"4 — 10"6%. Стоимость материалов возрастает по мере повышения их степени очистки. Все методы очистки металлов можно разделить на химические Физико-химические. Химические методы очистки заключаются во взаимодействии металлов с теми или иными реагентами, образующими с основными металлами или примесями осадки или газообразные продукты. Из-за контакта металла с реагентами и материалами аппаратуры не удается достичь высокой степени чистоты металла. Более высокую степень очистки дают транспортные химические реакции в которых металл с реагентом образует газообразные продукты, передаваемые в другую зону, где они разлагаются на чистый металл и исходный реагент.
Физико-химические методы включают в себя электрохимические, дистилляционные, кристаллизационные и др. При электрохимическом способе (рафинировании) очищаемый металл служит анодом, чистый металл осаждается на катоде электролизера, примеси переходят либо в раствор электролита, либо в виде осадка накапливаются в шламе (см. гл. 9). Дистилляционные методы заключаются в испарении жидкого (например, ртути) или расплавленного металла с последующей конденсацией паров. Отделение примесей обусловлено разной температурой испарения основного металла и примеси. Кристаллизационные методы основаны на различном содержании примесей в твердом и расплавленном металлах. Они включают зонную плавку, кристаллизационное вытягивание из расплава и др. Особенно широко применяют зонную плавку, заключающуюся в том, что вдоль слитка (стержня) медленно перемещается зона нагрева и соответственно зона расплавленного металла. Некоторые примеси концентрируются в расплаве и собираются в конце слитка, другие — в начале слитка. После многократных прогонок отрезают начальную и концевую части слитка, остается очищенная средняя часть металла ПОЛУЧЕНИЕ МЕТАЛЛОВ ВЫСОКОЙ ЧИСТОТЫ В связи с развитием в настоящее время новых отраслей техники и технологии требования к чистоте используемых материалов (металлов) постоянно повышаются. Перед современной металлургией остро стоит проблема разработки и освоения методик тонкой очистки металлов от примесей. С этой целью достаточно широко используют методы электролитического рафинирования металлов (см. гл.8 “Электрохимические процессы”) и некоторые другие. Перегонка и переплавка в вакууме основаны на различной летучести металлов. При определенной температуре примесь отделяют от менее летучего металла или, наоборот, отгоняют более летучий металл от менее летучих примесей. Таким образом, металлы (Nb, Ta, Mo, W, Re и др.) очищают, от растворенных в них газов (кислорода, водорода, азота и др.). В методе термической диссоциации (пиролиз) летучих соединений используют способность некоторых соединений металлов (галидов, карбонилов и др.) разлагаться при высоких температурах. Так, ряд металлов (Ti, Zr и др.) образуют с иодом при сравнительно низких температурах летучие соединения - иодиды, которые легко отделяют от примесей. При более высокой температуре пары иодидов на W- или Ta- проволоке разлагаются на чистый металл и иод:
ZrI2 = Zr + 2I Данный метод очистки металлов иногда называют методом транспортных реакций. Кроме иода в нем используют и другие реагенты, в частности, оксид углерода (II), при помощи которого в процессе очистки от примесей никеля, железа, кобальта, хрома и других металлов получают соответствующие карбонилы, которые, после отделения от примесей разлагают на чистый металл и CO: [Ni(CO)4] = Ni + 4CO Для получения чистых металлов в ряде случаев применяют метод диспропорционирования суть которого сводится к процессам внутримолекулярного окисления - восстановления или диспропорционирования солей некоторых металлов с образованием металлов: 2AuCl3 = Au + 3Cl2 2TiCl2 = TiCl4 + Ti Зонная плавка основана на различной растворимости примесей в твердом и расплавленном металле. Процесс заключается в том, что через высокотемпературную зону очень медленно передвигают стержень из очищаемого металла. Образующаяся при этом узкая зона расплавленного металла, в которой концентрируются примеси, перемещается в конец стержня со скоростью 2-3 см/час. Описанную операцию многократно повторяют. Конец стержня механически отделяют. Данным методом получают металлы, в которых остается один атом примеси на 10 атомов очищаемого металла. Металлы, находящиеся в чистом состоянии, отличаются по своим физическим свойствам от неочищенных. Например, полупроводниковые свойства у германия проявляются лишь в образцах с содержанием примесей 10. Чистый хром отличается от неочищенного высокой пластичностью, электро-, теплопроводностью. Изменяются и другие характеристики металлов.
45. МАГНИЙ (Magnesium) Mg, хим. элемент II гр. периодич. системы, ат. н. 12, ат. м. 24,305; относится к щелочноземельным элементам. Прир. магний состоит из трех стабильных изотопов 24Mg (78,60%), 25Mg (10,11%) и 26Mg (11,29%).Конфигурация внеш. электронной оболочки 3s2; степень окисления +2, очень редко +1. Содержание магния в земной коре 2,35% по массе. Встречается в природе только в виде соединений. Известно более 100 минералов, содержащих магний; большинство из них - силикаты и алюмосиликаты. Магний - серебристо-белый металл. Магний - сравнительно мягкий, пластичный и ковкий металл. При обычных условиях пов-сть магния защищена прочной пленкой магния оксида MgO, только при нагр. на воздухе до ~ 600 °С происходит разрушение этой пленки и металл сгорает ослепительно белым пламенем с образованием MgO и нитрида Mg3N2. С холодной водой магний не реагирует, из кипящей воды вытесняет Н2 и образует магния гидроксид Mg(OH)2. Аналогично реагирует с р-рами солей аммония. Бериллий (Be) - имеет атомный номер 4 и атомный вес 9.0122. Он находится во втором периоде периодической системы и возглавляет главную подгруппу 2 группы, в которую также входят магний, кальций, стронций, барий и радий. Электронная структура атома бериллия 1s 2s. На внешней оболочке он имеет два электрона, что является характерным для элементов этой группы. Электронная структура внешней оболочки иона каждого из этих элементов с зарядом +2 соответствует электронной структуре инертного газа с атомным номером на две единицы меньше номера рассматриваемого элемента. Бериллий вещество серо-стального цвета; при комнатной температуре металлический бериллий имеет плотно упакованную гексагональную решетку, подобную решетке магния. Атомный (металлический) радиус бериллия равен 1.13 А. Увеличение массы и заряда ядра при сохранении конфигурации электронных оболочек служит причиной резкого уменьшения атомного и ионного радиусов бериллия по сравнению с соседним литием. После отрыва валентных электронов атом бериллия образует ион типа благородных газов, и несет, подобно литию, всего одну электронную оболочку, но характеризуется значительно меньшими размерами и компактностью. Истинный ионный радиус бериллия - 0,34 А является наименьшим среди металлов. Потенциалы ионизации у бериллия равны (соответственно для первого, второго, третьего и четвертого электронов) I1-9,28; I2-18,12; I3-153,1; I4-216,6 эВ. На кривой потенциалов ионизации бериллий занимает одно из верхних мест. Последнее соответствует его малому радиусу и характеризует бериллий как элемент не особенно охотно отдающий свои электроны, что в первую очередь определяет степень химической активности элемента. Этот же фактор имеет решающее значение в образование того или иного типа химической связи при соединение бериллия с другими элементами. С точки зрения электроотрицательности бериллий наряду с алюминием может рассматриваться как типичный переходный элемент между электроположительными атомами металлов, легко отдающих свои электроны, и типичными комплексообразователями, имеющими тенденцию к образованию ковалентной связи. В нейтральных растворах гидрокcилы бериллия дисcоциируют по схеме:
Be2+ + OH- <=> Be(OH)2 <=> H2BeO2 <=> 2H+ + [BeO2]2- 46. Алюминий представляет собой серебристо–белый, довольно твердый металл с плотностью 2,7, плавящийся при 660° и кипящий при 2350°С. Он характеризуется большой тягучестью и высокой электропроводностью (составляющей 0,6 электропроводности меди). С этим связано его использование в производстве электрических проводов. Значительно более обширно применение алюминия в виде различных сплавов, наряду с хорошими механическими качествами характеризующихся своей легкостью. Особенно важен так называемый дуралюминий (приблизительный состав: 94% Аl, 4% Cu, по 0,5% Mg, Mn, Fe и Si). Он ценен тем, что при равной прочности изделия из него почти в три раза легче стальных. Не говоря уже об авиационной промышленности, для которой легкость материала особенно важна, облегчение металлических конструкций имеет громадное значение для ряда областей техники. Это становится особенно наглядным, если принять во внимание, что, например, в груженом товарном вагоне около трети всего веса приходится на материалы, из которых изготовлен сам вагон, а в пассажирских вагонах на их собственный вес падает до 95% всей нагрузки. Очевидно, что даже частичная замена стали дуралюминием дает громадный техно–экономический эффект. В связи с этим, а также ввиду наличия в природе практически неисчерпаемых запасов алюминия, его иногда называют «металлом будущего». Возможность широкой частичной замены им основного металла современной техники – железа – ограничивается главным образом сравнительно высокой стоимостью алюминия.Алюминий легкорастворим в сильных щелочах по реакции, например: 2Аl + 2NaOH + 2Н2 О = 2NaAlO2 + ЗН2 В ряду напряжений он располагается между Mg и Zn. Во всех своих устойчивых соединениях алюминий трехвалентен.Легкость растворения алюминия в сильныхшелочах обусловлена снятием с него защитной окисной пленки по схеме: Аl2 О3 + 2ОН– = 2АlO2 – +Н2 О. Тита́н (Ti) — элемент побочной подгруппы четвёртой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 22. Простое вещество титан— лёгкий металл серебристо-белого цвета. Титан находится на 10-м месте по распространённости в природе. Содержание в земной коре 0,57 % по массе. Практическое значение Ti и Zr особенно велико для металлургии. Присадка титана придает стали твердость и эластичность, а присадка циркония сильно повышает ее твердость и вязкость. За последнее время стало быстро развиваться использование титана в самолетостроении, а циркония – при сооружении ядерных реакторов. Соединения обоих элементов находят применение в различных отраслях промышленности. Как правило, исходным материалом для производства титана и его соединений служит диоксид титана со сравнительно небольшим количеством примесей. В частности, это может быть рутиловый концентрат, получаемый при обогащении титановых руд. Однако запасы рутила в мире весьма ограничены, и чаще применяют так называемый синтетический рутил или титановый шлак, получаемые при переработке ильменитовых концентратов. Для получения титанового шлака ильменитовый концентрат восстанавливают в электродуговой печи, при этом железо отделяется в металлическую фазу (чугун), а не восстановленные оксиды титана и примесей образуют шлаковую фазу. Богатый шлак перерабатывают хлоридным или сернокислотным способом. Концентрат титановых руд подвергают сернокислотной или пирометаллургической переработке. Продукт сернокислотной обработки — порошок диоксида титана TiO2. Пирометаллургическим методом руду спекают с коксом и обрабатывают хлором, получая пары тетрахлорида титана TiCl4:
Образующиеся пары TiCl4 при 850 °C восстанавливают магнием:
Полученную титановую «губку» переплавляют и очищают. Рафинируют титан иодидным способом или электролизом, выделяя Ti из TiCl4. Для получения титановых слитков применяют дуговую, электроннолучевую или плазменную переработку.Устойчив к коррозии благодаря оксидной плёнке, но при измельчении в порошок, а также в тонкой стружке или проволоке титан пирофорен[10]. Титан устойчив к разбавленным растворам многих кислот и щелочей (кроме HF, H3PO4 и концентрированной H2SO4). Легко реагирует даже со слабыми кислотами в присутствии комплексообразователей, например, с плавиковой кислотой HF он взаимодействует благодаря образованию комплексного аниона [TiF6]2−. При нагревании на воздухе до 1200 °C Ti загорается с образованием оксидных фаз переменного состава TiOx. Из растворов солей титана осаждается гидроксид TiO(OH)2·xH2O, осторожным прокаливанием которого получают оксид TiO2. Гидроксид TiO(OH)2·xH2O и диоксид TiO2 амфотерны. TiO2 взаимодействует с серной кислотой при длительном кипячении. При сплавлении с содой Na2CO3 или поташом K2CO3 оксид TiO2 образует титанаты:
При нагревании Ti взаимодействует с галогенами. Тетрахлорид титана TiCl4 при обычных условиях — бесцветная жидкость, сильно дымящая на воздухе, что объясняется гидролизом TiCl4 содержащимися в воздухе парами воды и образованием мельчайших капелек HCl и взвеси гидроксида титана. Восстановлением TiCl4 водородом, алюминием, кремнием, другими сильными восстановителями, получентрихлорид и дихлорид титана TiCl3 и TiCl2 — твёрдые вещества, обладающие сильными восстановительными свойствами.Ti взаимодействует с Br2 и I2. С азотом N2 выше 400 °C титан образует нитрид TiNx(x=0,58-1,00). При взаимодействии титана с углеродом образуется карбид титана TiCx (x=0,49-1,00). При нагревании Ti поглощает H2 с образованием соединения переменного состава TiHх (x=1,3 — 2). При нагревании эти гидриды разлагаются с выделением H2. Титан образует сплавы со многими металлами.
|
|||||||||
|
Последнее изменение этой страницы: 2016-04-19; просмотров: 9039; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.175.191 (0.016 с.) |