
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль.Содержание книги
Поиск на нашем сайте
Основные понятия и законы химии Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль. Химия – это наука о веществах, их связях и превращениях, которые сопровождаются изменениями химических и физических свойств. Основные задачи химии: 1) Исследование синтеза новых веществ с определёнными свойствами. 2) Направление синтеза новых веществ с определёнными свойствами. 3) Анализ явления веществ на среду обитания человека. Химический элемент – вид атомов с одинаковым зарядом ядер, т.е. числом протонов. Атом – электро - нейтральная частица, состоящая из «+» заряженного ядра и «-» заряженных электронов. При химическом взаимодействии атомов образуется молекула. Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию. Она может состоять из одинаковых(простое вещество) или различных(сложное вещество) атомов. Моль – это кол-во вещества, содержащее столько структурных единиц(молекул, атомов, ионов), сколько атомов содержится в 12г атома изотопа 12С.(n = N/Na. n = [моль]). Молярная масса – масса одного моль вещества. М = m/n [г/моль].
Законы: сохранения массы и энергии, постоянства состава, Авогадро, кратных отношений, простых объемных отношений, парциальных давлений Дальтона. ЗСМ: Масса веществ, вступивших в реакцию, равна массе веществ, образующихся в результате реакции. ЗСЭ: При любых взаимодействиях в изолированной системе энергия этой системы остаётся постоянной. Возможны лишь переходы из одного вида энергии в другой.(E=m*c2) ЗПС: При хим. Реакциях остаётся постоянной не только общая масса веществ, но и масса каждого элемента. ЗА: В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. (Закон Авогадро имеет несколько следствий: Первое следствие: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Второе следствие: Молярная масса любого газа равна удвоенной относительной его плотности по водороду. M(x)=M(H2)*DH2.) ЗКО: Если два элемента образуют несколько различных соединений, то на одну и ту же массу одного из них приходятся такие массы другого, которые относятся между собой, как простые целые числа. ЗОО: при постоянном давлении и температуре объемы газов, вступающих в химическую реакцию, находятся в простых отношениях друг к другу и к объемам газообразных продуктов реакции, то есть отношение объемов, в которых газы участвуют в реакции, соответствует отношению небольших целых чисел. ЗпдД: Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь. (Pобщ = P1 + P2 + … + Pn). Парциальное давление газа – это то давление, которое производило бы имеющееся в смеси кол-во газа, если бы оно занимало весь объём, занимаемый смесью.
Эквивалент элемента и вещества. Закон эквивалентов. Эквивалент — это реальная или условная частица, которая может присоединять, высвобождать или другим способом быть эквивалентна катиону водорода в ионообменных реакциях или электрону в окислительно-восстановительных реакциях. Например, в реакции: NaOH + HCl = NaCl + H2O эквивалентом будет реальная частица — ион Na+, а в реакции Zn(OH)2 + 2HCl = ZnCl2 + 2H2O эквивалентом будет являться мнимая частица ½Zn(OH)2. Под эквивалентом вещества также часто подразумевается количество эквивалентов вещества или эквивалентное количество вещества — число моль вещества, эквивалентное одному моль катионов водорода в рассматриваемой реакции. Число эквивалентности z представляет собой небольшое положительное целое число, равное числу эквивалентов некоторого вещества, содержащихся в 1 моль этого вещества. Фактор эквивалентности Э связан с числом эквивалентности z следующим соотношением: Э =1/z. Например, в реакции: Zn(OH)2 + 2HCl = ZnCl2 + 2H2O Эквивалентом является частица ½Zn(OH)2. Число ½ есть фактор эквивалентности, z в данном случае равно 2. Эквивалентная масса — это масса одного эквивалента данного вещества. Молярная масса эквивалентов вещества — масса одного моля эквивалентов, равная произведению фактора эквивалентности на молярную массу этого вещества. Mэкв = Э×M, или. Mэкв = M/z. Эквивалентный объём – отношение произведения молярного объёма на эквивалент элемента, к числу атомов элемента. Vэ=Vm*Э/N. В результате работ Рихтера(1792—1800) был открыт закон эквивалентов: Закон эквивалентов: все вещества реагируют и образуются в эквивалентных отношениях. m(A)/Mэкв(A)=m(B)/Mэкв(B), или V(A)/Vэкв(A)=V(B)/Vэкв(B). Расчет молярной массы эквивалента простого и сложного вещества. Молярная масса эквивалента простого вещества определяется как отношение молярной массы вещества к произведению числа атомов элемента в молекуле на его валентность. Мэ(х) = М(х)/Z Z=N*B B – валентность Молярная масса эквивалента оксида определяется как отношение молярной массы оксида к произведению числа атомов элемента в молекуле на его валентность. Мэ(х) = М(х)/Z Z=N*B B – валентность Молярная масса эквивалента кислоты определяется как отношение молярной массы кислоты к её основности. Основность кислоты определяется числом ионов водорода, способных замещаться на атомы металла. Мэ(х) = М(х)/Z Z=Nн+ Молярная масса эквивалента основания определяется как отношение молярной массы основания к его кислотности. Мэ(х) = М(х)/Z Z=Nон-. Молярная масса эквивалента веществ, участвующих в ОВР – это отношение молярной массы вещества к числу электронов, отданных или принятых веществом. Мэ(х) = М(х)/Z Z=Nе. Молярная масса эквивалента иона - это отношение молярной массы иона к его заряду. Мэ(х) = М(х)/Z Z – заряд иона. 5. Уравнение Менделеева-Клапейрона, основные газовые законы. Уравнение состояния идеального газа -формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид: p*Vм = R*T, гдеp — давление, Vм — молярный объём, R — универсальная газовая постоянная, T — абсолютная температура, К. Так какVм=V/n, где n — количество вещества, а n=m/M, где m — масса, M — молярная масса, уравнение состояния можно записать: p*V= n*R*T. В случае постоянной массы газа уравнение можно записать в виде: p*V/T=const. Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта (Если Т=const, то p*V=const), Шарля (Если V=const, то p/T=const) и Гей-Люссака (Если p=const, тоV/T=const). А в форме пропорции P1*V1/T1=P2*V2/T2 этот закон удобен для расчёта перевода газа из одного состояния в другое. Закон Авогадро: В равных объёмах различных газов, взятых при одинаковых температуре и давлении, содержится одно и то же число молекул. (Закон Авогадро имеет несколько следствий: Первое следствие: один моль любого газа при одинаковых условиях занимает одинаковый объём. В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа, равен 22,4 л. Этот объём называют молярным объёмом газа Vm. Второе следствие: Молярная масса любого газа равна удвоенной относительной его плотности по водороду. M(x)=M(H2)*DH2.). Закон парциальных давлений: Давление смеси газов, химически не взаимодействующих друг с другом, равно сумме парциальных давлений газов, составляющих смесь. (Pобщ = P1 + P2 + … + Pn). Парциальное давление газа – это то давление, которое производило бы имеющееся в смеси кол-во газа, если бы оно занимало весь объём, занимаемый смесью. Строение и свойства атомов 1.Квантово-механическая модель строения атома, уравнение де Бройля, принцип Гейзенберга, волновая функция, уравнение Шредингера. К сожалению, описать атомы со сложной структурой, опираясь на модель Бора, не представляется возможным. Поэтому, в 20-х годах прошлого века получила широкое распространение квантово-механическая модель (КММ) атома. В основу КММ положена квантовая теория атома, согласно которой электрон обладает как свойствами частицы, так и свойствами волны. Другими словами, о местоположении электрона в определенной точке можно судить не точно, а с определенной долей вероятности. Поэтому в КММ орбиты Бора заменили орбиталями ("электронные облака" - области пространства в которых существует вероятность пребывания электрона). Состояние электрона в атоме описывают с помощью 4 чисел, которые называют квантовыми: Главное квантовое число n (описывает Энергетический уровень орбитали, принимает значения n=1,2,3,…). Чем больше значение n, тем выше энергия электрона и больше размер электронного облака. Если в атоме несколько электронов с одинаковым n, то они образуют электронные облака одинакового размера - электронные оболочки. Орбитальное квантовое число L (Описывает форму орбитали, принимает значения от 0 до n-1). Орбитали, имеющие одинаковое n, но разные L называют энергетическими подуровнями и обозначают буквами латинского алфавита: s,p,d,f,g. Магнитное квантовое число m (Описывает ориентацию орбиталей в пространстве, принимает значения -L,0,L). Например: Для L=0 возможно только одно значение: m=0. Это значит, что s-орбиталь имеет только одну пространственную ориентацию. Для L=1: m=-1;0;+1 - p-орбиталь имеет три пространственные ориентации. Cпиновое квантовое число ms (Описывает направление вращения электрона в магнитном поле - по часовой стрелке или против. На каждой орбитали может находиться только два электрона: один со спином +½ другой -½). Для частиц не очень высокой энергии, движущихся со скоростью v<<c (скорости свет), Метод электронного баланса. Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений. Оба метода основаны на реализации двух принципов: 1.Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым; 2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Основные этапы составления уравнений реакций по методу электронного баланса: 1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель. Например:
Электролиз. Законы Фарадея. Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую, что позволяет осуществлять такие ОВР, которые не могут протекать самопроизвольно. Ячейка, в которой осуществляют электролиз, называется электролизёром и состоит из двух электродов и электролита. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем происходит окисление. Электрод, подключенный к отрицательному полюсу, называется катодом, на нем идет восстановительный процесс. Минимальное напряжение электрического тока, приложенное к электродам, при котором начинается электролиз вещества, называется потенциалом разложения U разл. Теоретически U разл должен быть равен разности окислительно-восстановительных потенциалов процессов, протекающих на электродах U разл = Е анодного процесса – Е катодного процесса. Однако на практике, чтобы начался электролиз, к электродам приходится прикладывать напряжение, заметно превышающее потенциал разложения вещества. Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.). Различают электролиз расплавов и электролиз водных растворов. Электролиз расплавов электролитов обычно ведут с использованием инертных (неактивных, нерасходуемых) электродов, то есть электродов, выполненных из материалов, которые в процессе электролиза химически не изменяются, а служат лишь для передачи электронов. Инертные электроды обычно изготовляются из графита, угля, платины. Кроме инертных анодов различают также растворимые (активные, расходуемые) аноды. Это аноды, выполненные из активных материалов (меди, цинка, никеля, железа и других металлов). У таких анодов в процессе электролиза окисляется в первую очередь сам материал анода. Электролизводных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды: 1) восстанавливаться на катоде по схеме 2Н2О + 2 ē ® Н2 + 2ОН–. 2) окисляться на аноде по схеме 2Н2О – 4 ē ® О2 + 4Н+. Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает: 1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала; 2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала. Первый закон Фарадея: масса вещества, испытавшего электрохимические превращения на электроде, прямо пропорциональна количеству прошедшего через электролизер электричества. Произведение растворимости. Произведение растворимости (ПР), труднорастворимого сильного электролита, равно произведению молярных концентраций его ионов в степенях, соответствующих стехиометрическим коэффициентам в насыщенном растворе. Для двухфазного равновесия насыщенный раствор - осадок KnAm <=> nK+ + mA- произведение растворимости (ПР) будет равно ПР = [K+]n*[A-]m Размерность произведения растворимости dim ПР = L-(n+m)N(n+m) (моль(n+m)/л(n+m)) При данной температуре произведение растворимости, есть величина постоянная, которую используют в качестве характеристики растворимости электролита. Из двух веществ большей растворимостью обладает то, ПР которого больше. Для того чтобы определить выпадет ли осадок в растворе, достаточно знать произведение растворимости и концентрации ионов образующих труднорастворимое соединение, вычислив произведение концентраций (ПК) ионов в степенях, соответствующих стехиометрическим коэффициентам для данного раствора. Если ПР = ПК, то система находится в состоянии равновесия (раствор насыщенный). Если ПР > ПК, то осадок не выпадает. Если ПР < ПК, то из раствора выпадает осадок.
Основные понятия и законы химии Химия как раздел естествознания. Понятия: вещество, молекула, атом, моль. Химия – это наука о веществах, их связях и превращениях, которые сопровождаются изменениями химических и физических свойств. Основные задачи химии: 1) Исследование синтеза новых веществ с определёнными свойствами. 2) Направление синтеза новых веществ с определёнными свойствами. 3) Анализ явления веществ на среду обитания человека. Химический элемент – вид атомов с одинаковым зарядом ядер, т.е. числом протонов. Атом – электро - нейтральная частица, состоящая из «+» заряженного ядра и «-» заряженных электронов. При химическом взаимодействии атомов образуется молекула. Молекула – наименьшая частица индивидуального вещества, способная к самостоятельному существованию. Она может состоять из одинаковых(простое вещество) или различных(сложное вещество) атомов. Моль – это кол-во вещества, содержащее столько структурных единиц(молекул, атомов, ионов), сколько атомов содержится в 12г атома изотопа 12С.(n = N/Na. n = [моль]). Молярная масса – масса одного моль вещества. М = m/n [г/моль].
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 1292; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.01 с.) |

 , где h=6,626*10-34Дж*с – постоянная Планка. Волновая функция, или пси-функция
, где h=6,626*10-34Дж*с – постоянная Планка. Волновая функция, или пси-функция  — функция, используемая в квантовой механике для описания движения электрона в атоме.
— функция, используемая в квантовой механике для описания движения электрона в атоме. 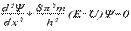 , де x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы. В 1927г. Гейзенберг постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств.
, де x — расстояние, h — постоянная Планка, а m, E и U — соответственно масса, полная энергия и потенциальная энергия частицы. В 1927г. Гейзенберг постулировал принцип неопределённости, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. … Очевидно, что СО изменяется у марганца (уменьшается) и у железа (увеличивается). Таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель. 2. Составляют полуреакции окисления и восстановления:
… Очевидно, что СО изменяется у марганца (уменьшается) и у железа (увеличивается). Таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель. 2. Составляют полуреакции окисления и восстановления:  (восстановление),
(восстановление),  (окисление). 3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:
(окисление). 3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:  ½´ 1½´ 2,
½´ 1½´ 2,  , где m – масса вещества, г; M э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с. Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой
, где m – масса вещества, г; M э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с. Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой  , где V э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3. Второй закон Фарадея: массы веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов
, где V э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3. Второй закон Фарадея: массы веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов  .
.


