
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Гальванические элементы. ЭДС гальванического элемента.Содержание книги
Поиск на нашем сайте
Процессы превращения энергии химической реакции в электрическую лежат в основе работы химических источников тока (ХИТ). К ХИТ относятся гальванические элементы, аккумуляторы и топливные элементы. Гальваническим элементом называют устройство для прямого преобразования энергии химической реакции в электрическую, в котором реагенты (окислитель и восстановитель) входят непосредственно в состав элемента и расходуются в процессе его работы. После расхода реагентов элемент не может больше работать, то есть это – ХИТ одноразового действия. Гальванический элемент состоит их двух полуэлементов (окислительно-восстановительных систем), соединенных между собой металлическим проводником. Полуэлемент (иначе электрод) чаще всего представляет собой металл, помещенный в раствор, содержащий ионы, способные восстанавливаться или окисляться. Каждый электрод характеризуется определенным значением условного электродного потенциала Е, который в стандартных условиях определяется экспериментально относительно потенциала стандартного водородного электрода (СВЭ). СВЭ – это газовый электрод, который состоит из платины, контактирующей с газообразным водородом (Р Электролиз. Законы Фарадея. Электролизом называют окислительно-восстановительный процесс, протекающий при прохождении постоянного электрического тока через раствор или расплав электролита. При электролизе происходит превращение электрической энергии в химическую, что позволяет осуществлять такие ОВР, которые не могут протекать самопроизвольно. Ячейка, в которой осуществляют электролиз, называется электролизёром и состоит из двух электродов и электролита. Электрод, подключенный к положительному полюсу внешнего источника тока, называется анодом, на нем происходит окисление. Электрод, подключенный к отрицательному полюсу, называется катодом, на нем идет восстановительный процесс. Минимальное напряжение электрического тока, приложенное к электродам, при котором начинается электролиз вещества, называется потенциалом разложения U разл. Теоретически U разл должен быть равен разности окислительно-восстановительных потенциалов процессов, протекающих на электродах U разл = Е анодного процесса – Е катодного процесса. Однако на практике, чтобы начался электролиз, к электродам приходится прикладывать напряжение, заметно превышающее потенциал разложения вещества. Характер протекания электродных процессов при электролизе зависит от многих факторов, важнейшими из которых являются состав электролита, материал электродов и режим электролиза (температура, напряжение, плотность тока и др.). Различают электролиз расплавов и электролиз водных растворов. Электролиз расплавов электролитов обычно ведут с использованием инертных (неактивных, нерасходуемых) электродов, то есть электродов, выполненных из материалов, которые в процессе электролиза химически не изменяются, а служат лишь для передачи электронов. Инертные электроды обычно изготовляются из графита, угля, платины. Кроме инертных анодов различают также растворимые (активные, расходуемые) аноды. Это аноды, выполненные из активных материалов (меди, цинка, никеля, железа и других металлов). У таких анодов в процессе электролиза окисляется в первую очередь сам материал анода. Электролизводных растворов электролитов более сложен, так как кроме ионов электролита на электродах могут претерпевать изменение молекулы воды: 1) восстанавливаться на катоде по схеме 2Н2О + 2 ē ® Н2 + 2ОН–. 2) окисляться на аноде по схеме 2Н2О – 4 ē ® О2 + 4Н+. Таким образом, при электролизе водных растворов электролитов на каждом из электродов принципиально возможно протекание двух или большего числа процессов. Из ряда конкурирующих процессов на электроде в первую очередь реализуется тот процесс, осуществление которого связано с меньшими затратами энергии. Это означает: 1. На катоде восстанавливаются в первую очередь окисленные формы систем с наибольшим значением окислительно-восстановительного потенциала; 2. На аноде в первую очередь окисляются восстановленные формы систем, которые имеют меньшее значение окислительно-восстановительного потенциала. Первый закон Фарадея: масса вещества, испытавшего электрохимические превращения на электроде, прямо пропорциональна количеству прошедшего через электролизер электричества.
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 453; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.87.157 (0.006 с.) |

 = 1 атм) и раствором, в котором активность ионов водорода а
= 1 атм) и раствором, в котором активность ионов водорода а 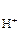 = 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ +
= 1 моль/дм3. Равновесие в водородном электроде отражается уравнением Н+ +  «½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е
«½ Н2. Абсолютное значение потенциала СВЭ неизвестно, но условно его считают равным нулю (Е  = 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Ме n + :
= 0 В). Потенциалы электродов рассчитывают по уравнению Нернста, которое при температуре 298 К имеет вид: 1) для металлических электродов I рода, то есть когда металл Ме погружен в раствор, содержащий ионы данного металла Ме n + :  , где Е
, где Е  - стандартный электродный потенциал металла, В; а
- стандартный электродный потенциал металла, В; а  - активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода: D Е = Е катод – Е анод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе D Е > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита.
- активность ионов металла в растворе, моль/дм3. Значения стандартных электродных потенциалов практически для всех металлов определены экспериментально и содержатся в справочной литературе. В гальваническом элементе электрод, имеющий меньшее значение потенциала, называется анодом и обозначается знаком «–». На аноде идет окисление частиц восстановителя. Электрод, обладающий большим потенциалом, называется катодом и обозначается знаком «+». На катоде происходит восстановление частиц окислителя. Переход электронов с восстановителя на окислитель происходит по металлическому проводнику, который называют внешней цепью. ОВР, лежащая в основе работы гальванического элемента, называется токообразующей реакцией. Основной характеристикой работы элемента является его ЭДС D Е, которая вычисляется как разность между потенциалами катода и анода: D Е = Е катод – Е анод. Поскольку потенциал катода всегда больше потенциала анода, то из формулы следует, что в работающем гальваническом элементе D Е > 0. Гальванические элементы принято записывать в виде схем, в которых одна вертикальная линия изображает границу раздела фаз (металл – раствор), а две вертикальные линии – границу между двумя растворами. На практике электрический контакт между растворами обеспечивается с помощью солевогомостика – U-образной трубки с раствором электролита. , где m – масса вещества, г; M э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с. Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой
, где m – масса вещества, г; M э – молярная эквивалентная масса вещества, г/моль; I – сила тока, А; t - время, с. Если на электроде испытывает превращение газообразное вещество, то удобнее определять его объем V (дм3), а не массу, тогда первый закон Фарадея можно представить формулой  , где V э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3. Второй закон Фарадея: массы веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов
, где V э – молярный эквивалентный объем выделяющегося или поглощающегося газа, моль/дм3. Второй закон Фарадея: массы веществ, прореагировавших на электродах, при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов  .
.


