
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Катализаторы, каталитические системы.Содержание книги
Поиск на нашем сайте
Катализатор — химическое вещество, ускоряющее реакцию, но не входящее в состав продуктов реакции[1]. Количество катализатора, в отличие от реагентов, после реакции не изменяется. Важно понимать, что катализатор не участвует в реакции. Они обеспечивают более быстрый путь для реакции, катализатор реагирует с исходным веществом, получившееся промежуточное соединение подвергается превращениям и в конце расщепляется на продукт и катализатор. Затем катализатор снова реагирует с исходным веществом, и этот каталитический цикл многократно повторяется. Катализаторы подразделяются на гомогенные и гетерогенные. Гомогенный катализатор находится в одной фазе с реагирующими веществами, гетерогенный — образует самостоятельную фазу, отделённую границей раздела от фазы, в которой находятся реагирующие вещества. Типичными гомогенными катализаторами являются кислоты и основания. В качестве гетерогенных катализаторов применяются металлы, их оксиды и сульфиды. Обычно каталитическая система состоит из: •специальной сотовой конструкции. Соты нужны, чтобы увеличить площадь реакции между газообразной жидкостью и твердой поверхностью. • активной фазы (= катализатора), обычно из металла или оксида, которая поставляет активные центры, в которых происходит химическая реакция. Окислительно-восстановительные реакции. Электрохимические системы Окислительно-восстановительная способность веществ. Типы ОВР. Реакции, протекающие с изменением степеней окисления элементов в веществах, называются окислительно-восстановительными. Любая окислительно-восстановительная реакция (ОВР) состоит из двух сопряженных процессов: 1. Окисление – это процесс отдачи электронов частицей, который приводит к повышению СО элемента: Метод электронного баланса. Существует несколько способов подбора коэффициентов в уравнениях ОВР, из которых наиболее распространены метод электронного баланса и метод ионно-электронных уравнений. Оба метода основаны на реализации двух принципов: 1.Принцип материального баланса – число атомов всех элементов до и после реакции должно быть одинаковым; 2. Принцип электронного баланса – число электронов, отданных восстановителем, должно быть равно числу электронов, принятых окислителем. Метод электронного баланса является универсальным, то есть им можно пользоваться для уравнивания ОВР, протекающих в любых условиях. Основные этапы составления уравнений реакций по методу электронного баланса: 1. Записывают схему реакции, определяют СО элементов, выявляют окислитель и восстановитель. Например:
|
||||
|
Последнее изменение этой страницы: 2016-04-21; просмотров: 567; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.65.133 (0.007 с.) |

 . 2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением СО элемента:
. 2. Восстановление – это процесс приема электронов частицей, который сопровождается уменьшением СО элемента: 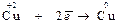 . Вещества, отдающие свои электроны в процессе окисления, называют восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Проявление тех или иных окислительно-восстановительных свойств атомов зависит от многих факторов, важнейшие из которых – положение элемента в Периодической системе, его СО в веществе, характер свойств, проявляемых другими участниками реакции. По окислительно-восстановительной активности вещества можно условно разделить на три группы: 1. Типичные восстановители – это простые вещества, атомы которых имеют невысокие значения ЭО (например, металлы, водород, углерод), а также частицы, в которых имеются атомы в минимальной (низшей) для них степени окисления (например, хлор в соединении H+1Cl-1). 2. Типичные окислители – это простые вещества, атомы которых характеризуются высокой ЭО (например, фтор и кислород), а также частицы, в составе которых имеются атомы в высшей (максимальной) СО (например, хром в соединении K+12Cr+6O-24). 3. Вещества, обладающие окислительно-восстановительной двойственностью свойст, – это многие неметаллы (например, сера и фосфор), а также вещества, содержащие элементы в промежуточной СО (например, марганец в соединении Mn+4O-22). Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например:
. Вещества, отдающие свои электроны в процессе окисления, называют восстановителями, а вещества, принимающие электроны в процессе восстановления, являются окислителями. Проявление тех или иных окислительно-восстановительных свойств атомов зависит от многих факторов, важнейшие из которых – положение элемента в Периодической системе, его СО в веществе, характер свойств, проявляемых другими участниками реакции. По окислительно-восстановительной активности вещества можно условно разделить на три группы: 1. Типичные восстановители – это простые вещества, атомы которых имеют невысокие значения ЭО (например, металлы, водород, углерод), а также частицы, в которых имеются атомы в минимальной (низшей) для них степени окисления (например, хлор в соединении H+1Cl-1). 2. Типичные окислители – это простые вещества, атомы которых характеризуются высокой ЭО (например, фтор и кислород), а также частицы, в составе которых имеются атомы в высшей (максимальной) СО (например, хром в соединении K+12Cr+6O-24). 3. Вещества, обладающие окислительно-восстановительной двойственностью свойст, – это многие неметаллы (например, сера и фосфор), а также вещества, содержащие элементы в промежуточной СО (например, марганец в соединении Mn+4O-22). Реакции, в которых окислители и восстановители представляют собой различные вещества, называются межмолекулярными. Например:  . В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными, например:
. В некоторых реакциях окислителем и восстановителем являются атомы различных по природе элементов одной и той же молекулы, такие ОВР называются внутримолекулярными, например:  . Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования, например:
. Реакции, в ходе которых окислителем и восстановителем является атом одного и того же элемента, находящегося в составе одного и того же вещества, называются реакциями диспропорционирования, например:  .
. … Очевидно, что СО изменяется у марганца (уменьшается) и у железа (увеличивается). Таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель. 2. Составляют полуреакции окисления и восстановления:
… Очевидно, что СО изменяется у марганца (уменьшается) и у железа (увеличивается). Таким образом, KMnO4 – окислитель, а FeSO4 – восстановитель. 2. Составляют полуреакции окисления и восстановления:  (восстановление),
(восстановление),  (окисление). 3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:
(окисление). 3. Балансируют количество принятых и отданных электронов путем переноса коэффициентов, стоящих перед электронами, в виде множителей, поменяв их местами:  ½´ 1½´ 2,
½´ 1½´ 2, 


