
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартные термодинамические функции
Данные термодинамические функции относятся к 1 моль вещества и при расчетах должны быть умножены на стехиометрические коэффициенты. 3. Изменение энтальпии химической реакции рассчитываем по формуле следствия из закона Гесса: ΔНх.р = Для построения энтальпийной диаграммы, определяем сумму энтальпий образования исходных веществ и продуктов реакции отдельно: ∑ΔНобр. исх. в-в = - 275,4 кДж; ∑ΔНобр. прод. р-ии = - 524,7 кДж (рис.4). 4. В ходе реакции энергия выделяется, 5. Изменение стандартной энтропии химической реакции рассчитываем по формуле следствия из закона Гесса: ΔSх.р = Уменьшение энтропии в ходе реакции свидетельствует об упорядочении системы – уменьшении числа газообразных молекул и об обратимости данного процесса.
6. Изменение стандартной энергии Гиббса химической реакции рассчитываем по формуле следствия из закона Гесса: ΔGх.р = =0 – 492,8 – 0 – 3(- 94,79) = - 492,8 + 284,37 = - 208,43 кДж/моль По уравнению Гиббса: ΔG = - 249,3 - 298·(- 272,32·10-3) = - 249,3 + 81,15 = - 168,15 кДж/моль. Отрицательный знак изобарного потенциала (Δ G<0) свидетельствует о возможности протекания реакции в стандартных условиях. Разница в величинах Δ G, рассчитанных двумя путями находится в пределах допустимого (15 %). 7.Поскольку ΔS<0 и ΔH<0, то реакция обратима. 8. Для данной реакции рассчитаем температуру равновесия (Тр) и сравним со значением Тр на графике:
9. Получим зависимость ΔG = f (T), рассчитав величину ΔG при Т = 500, 1000, 1500 К. Δ G500 = - 249,3 - 500·(- 272,32·10-3) = - 249,3 + 136,16 = - 113,14 кДж/моль
Δ G1000 = - 249,3 - 1000·(- 272,32·10-3) = - 249,3 + 272,32 = 23,02 кДж/моль Δ G1500 = - 249,3 - 1500·(- 272,32·10-3) = - 249,3 + 408,48 = 159,18 кДж/моль Строим по полученным данным зависимость ΔG = f (T), (рис. 5).
Рис. 5. График зависимости ΔGх.р. = f (T).
10. Вывод: реакция обратимая, экзотермическая, протекает при стандартных условиях и возможна в температурном интервале при значениях ΔG< 0, т. е. при температуре ниже 915,47 К. 3.4. Индивидуальные задания Задание 1. Дайте термодинамическую характеристику процесса (табл. 22). Таблица 22 Варианты контрольного задания
Продолжение табл. 22
Задание 2. Решите задачу своего варианта (табл. 23). Таблица 23 Варианты контрольного задания
Продолжение табл. 23
3.5. Тестовые задания 1. Формулировкой I закона термодинамики является: а) В реакциях, протекающих при постоянном давлении, изменение энтальпии равно изобарному тепловому эффекту реакции, взятому с противоположным знаком. б) Тепловой эффект реакции зависит от химической природы и агрегатного состояния исходных веществ и продуктов, но не зависит от пути ее протекания. в) В изолированной системе самопроизвольно протекают процессы в направлении большего беспорядка или наиболее вероятного существования системы. г) Энергия не может ни появляться, ни исчезать, она может только переходить из одного состояния в другое. 2. Реакция невозможна при любых температурах в случае: а) ΔH > 0, ΔS > 0 в) ΔH < 0, ΔS < 0 б) ΔH > 0, ΔS < 0 г) ΔH < 0, ΔS = 0 3. Указать знак ΔG процесса таяния льда при 273 К: а) ΔG > 0 б) ΔG = 0 в) ΔG < 0 г) ΔG = ¥ 4. Реакция возможна при любых температурах в случае: а) ΔH > 0, ΔS > 0 в) ΔH < 0, ΔS < 0 б) ΔH < 0, ΔS > 0 г) ΔH = 0, ΔS < 0 5. Укажите, для какого процесса энтропия увеличивается а) б) 6. Укажите термохимическое уравнение реакции, выражающее эндотермический процесс: а) б) в) г) 7. С увеличением энтропии протекают процессы а) нагревание б) испарение в) кристаллизация г) конденсация 8. В результате реакции, термохимическое уравнение которой а) 40 б) 80 в) 120 г) 135 9. Максимальное значение энтропии имеет а) С (алмаз) б) С (графит) в) СО2 (Г) г) СО(Г) 10. Тепловой эффект реакции зависит от начального и конечного состояния системы и не зависит от ее промежуточных состояний, закон _________.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 498; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.86.138 (0.023 с.) |
 ΔН0298(Н2(г)) + ΔН0298(GaCl3(т)) - ΔН0298(Ga(т)) - 3 ΔН0298(HCl(г)) = 0 – 524,7 – 0 – 3(- 91,8) = - 524,7 + 275,4 = - 249,3 кДж/моль
ΔН0298(Н2(г)) + ΔН0298(GaCl3(т)) - ΔН0298(Ga(т)) - 3 ΔН0298(HCl(г)) = 0 – 524,7 – 0 – 3(- 91,8) = - 524,7 + 275,4 = - 249,3 кДж/моль < 0, реакция экзотермическая. Выделение тепла вызывает повышение температуры.
< 0, реакция экзотермическая. Выделение тепла вызывает повышение температуры. 130,52 + 133,4 – 41,1 – 3·186,8 = 195,78 + 133,4 - 560,4 - 41,1 = 329,18– 601,5 = -272,32 Дж/(моль·K)
130,52 + 133,4 – 41,1 – 3·186,8 = 195,78 + 133,4 - 560,4 - 41,1 = 329,18– 601,5 = -272,32 Дж/(моль·K) = 915,47 K
= 915,47 K






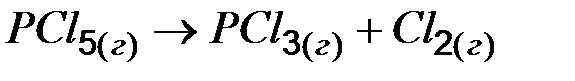








 в)
в) 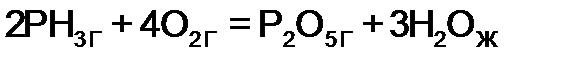
 г)
г) 




 , выделилось 1906,5 кДж, масса кальция вступившего в реакцию составила______г
, выделилось 1906,5 кДж, масса кальция вступившего в реакцию составила______г


