
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Смещение химического равновесия (принцип ле шателье)Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Равновесие можно сместить внешним воздействием, руководствуясь принципомЛе Шателье: если на равновесную систему оказывать внешнее воздействие, то равновесие смещается в сторону той реакции, которая способствует ослаблению этого воздействия. Влияние температуры. Для реакций, идущих с уменьшением энтальпии (экзотермических), повышение температуры будет препятствовать протеканию прямого процесса, то есть смещать реакцию в сторону исходных веществ. Эндотермические реакции при этом будут смещаться в сторону конечных продуктов. Например, при обычных условиях реакция N2 + O2 не идет (Δ H >0), но повышение температуры может сделать эти реакцию осуществимой. Реакция CO+1/2O2=CO2, Δ H <0 с повышением температуры будут смещаться в сторону исходных веществ. Влияние давления. Если реагируют газообразные вещества, то при неизменном числе молей начальных и конечных реагентов повышение общего давления не приведет к смещению равновесия. Если число молей при реакции меняется, то изменение общего давления приведет к смещению равновесия. В частности, реакция 2CO+O2=2CO2, протекающая с уменьшением количества вещества, при повышении общего давления сместится в сторону образования СO2. Влияние концентраций. В тех реакциях, в которых лучше оперировать концентрациями (реакции в растворах), увеличениеконцентраций исходных веществ приводит к смещению равновесия в сторону конечных продуктов и наоборот. Так, в реакции этерификации (образование сложного эфира) увеличение концентрации уксусной кислоты или этанола увеличивает выход этилацетата, а добавление в систему воды приводит к омылению, т. е. образованию исходных продуктов реакции.
4.2. Контрольные вопросы и задания 1. Что такое средняя и мгновенная скорость реакции? Охарактеризуйте факторы, влияющие на скорость химических реакций (в гомогенных и гетерогенных системах). 2. Зависимость скорости от концентрации. Закон действующих масс. Константа скорости реакции. 3. Зависимость скорости реакции от температуры. Уравнение Аррениуса. 4. Характеристика энергии активации. Энергия активации каталитических реакций и сущность действия катализатора. 5. Понятие о ферментативном катализе в биологических системах. Гомогенный и гетерогенный катализ.
6. Обратимые и необратимые химические реакции. Константа равновесия и ее расчет по стандартным изменениям энергии Гиббса. 7. Химическое равновесие. Закон химического равновесия. Определение смещения равновесия при изменении условий на основании принципа Ле-Шателье. 8. Как изменится скорость прямой реакции: 2NO + O2 = 2NO2 при увеличении концентрации NO в три раза; при одновременном уменьшении концентрации NO и NO2 в два раза? 9. Как изменится скорость реакции при повышении температуры от 30 0С до 80 0С, если температурный коэффициент равен 3? 10. Чему равен температурный коэффициент скорости реакции, если при увеличении температуры на 30 0С скорость реакции возрастает в 15,6 раза? 11. Запишите математическое выражение скоростей реакций, протекающих по уравнениям:
12. Как следует изменить давление в системе, чтобы скорость реакции увеличилась в 27 раз? Реакция протекает по уравнению: 13. Реакция протекает в газовой фазе и заканчивается за 60 с. Как изменится время ее течения при повышении температуры на 400 С, если 14. При некоторой температуре равновесные концентрации в системе 15. В какую сторону сместится равновесие в системе, если повысить t0, р, С одного из исходных веществ? Запишите выражение константы равновесия для приведенных ниже обратимых систем:
Примеры решения задач Пример 1. Во сколько раз изменится скорость реакции Решение. Предположим, что рассматриваемая реакция является элементарной, т. Е. для нее справедлив закон действующих масс
Принимая, что концентрация и парциальное давление связаны прямо пропорциональной зависимостью: После увеличения давления в системе в 2 раза парциальное давление каждого из реагентов возрастает тоже в 2 раза, т.е.
Отсюда Пример 2. Вычислите, во сколько раз возрастет скорость реакции при увеличении температуры на 40 0С, если температурный коэффициент реакции равен 3?
Решение. Согласно математическому выражению правила Вант-Гоффа
В нашем примере Т2 – Т1 = 400 С, подставив данные задачи в уравнение, получим uТ2/ uТ1 = 3 40/10 = 34 = 81, т.е. скорость реакции возросла в 81 раз. Пример 3. При 353 К реакция заканчивается за 20 сек. Сколько времени длится реакция при 293 К, если температурный коэффициент реакции равен 2,5? Решение. Между скоростью протекания химических реакций и их продолжительностью существует обратно – пропорциональная зависимость uТ2/ uТ1 = t1/ t2, где t1 и t2 – время протекания реакции при температурах Т1 и Т2, таким образом, в данном случае правило Вант-Гоффа можно записать следующим выражением: t1/ t2 = gТ2 –Т1/10; t1 = t2 ∙ gТ2-Т1/ 10 = 20 ∙ 2,5 353-293/ 10 =20 ∙ 2,56 = 4879 сек = = 1 час 21 мин 19 сек. Пример 4. При синтезе аммиака равновесие установилось при следующих концентрациях реагирующих веществ: [N2] = 2,5 моль/л; [Н2] = 1,8 моль/л; [NH3] = 3,6 моль/л. Рассчитайте константу равновесия этой реакции и исходные концентрации азота и водорода. Решение. Исходя из уравнения реакции получения аммиака
Исходные концентрации азота и водорода находим на основе уравнения реакции. На образование 2 моль аммиака расходуется 1 моль азота, а на образование 3,6 моль потребовалось 3,6 /2 = 1,8 моль азота. Учитывая равновесную концентрацию азота, находим первоначальную концентрацию Пример 5. В каком направлении произойдет смещение равновесия систем: а) 2SO3 = 2SO2 + O2 ∆H = +192 кДж б) 2СО =СО2 + С ∆H = -171 кДж в) COCl2 = CO + Cl2 ∆H = +113 кДж при повышении давления, температуры и понижении концентрации О2 и СО? Решение. а) реакция эндотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в прямую сторону (→). Количество моль газообразных исходных веществ – 2, продуктов – 3, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в обратную сторону (←). При понижении концентрации кислорода по принципу Ле-Шателье равновесие смещается в сторону прямой реакции (→). б) реакция экзотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в сторону эндотермической реакции, т.е. в обратную сторону (←). Количество моль газообразных исходных веществ – 2, продуктов – 1, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в сторону прямой реакции (→). При понижении концентрации угарного газа по принципу Ле-Шателье равновесие смещается в сторону обратной реакции (←). в) реакция эндотермическая, следовательно, при повышении температуры по принципу Ле-Шателье равновесие смещается в прямую сторону (→). Количество моль газообразных исходных веществ – 1, продуктов – 2, следовательно, при повышении давления равновесие смещается в сторону с меньшем количеством газообразных молекул, т.е. в обратную сторону (←). При понижении концентрации угарного газа по принципу Ле-Шателье равновесие смещается в сторону прямой реакции (→).
4.4. Индивидуальные задания Задание 1. Решите задачи своего варианта (табл. 24) Таблица 24 Варианты контрольного задания
Продолжение табл. 24
Продолжение табл. 24
Окончание табл. 24
4.5. Тестовые задания
1. Скорость химических процессов при введении в систему катализатора увеличивается за счет: а) увеличения кинетической энергии молекул б) возрастания числа столкновений в) уменьшения числа активных молекул г) уменьшения энергии активации 2. Равновесие гетерогенной системы СО2(г) + С(графит) ↔ 2СО(г ) смещается в сторону исходных веществ путем: а) увеличение объема б) повышения давления в) повышение концентрации углекислого газа г) понижение концентрации угарного газа 3. Закон «действующих масс» (Гульберг, Вааге) устанавливает зависимость скорости реакции от: а) температуры процесса б) химической природы реагирующих веществ в) концентрации реагирующих веществ г) катализатора 4. Кинетическим уравнением для гомогенного процесса 2NО(г)+О2(г)=2NО2(г) является: а) б) 5. Укажите определение энергии активации химического процесса: а) общий запас внутренней энергии системы; б) разница между потенциальной энергией молекул продуктов реакции и исходных веществ в) внутренняя энергия химической системы, способная совершать механическую работу. г) избыточная кинетическая энергия молекул, которая позволяет разрушить связи между атомами, что приводит к образованию новых химических связей. 6. Скорость реакции а) 4 раза б) 8 раз в) 16 раз г) 32 раза 7. При охлаждении равновесие реакции а) сместиться влево б) сместиться в право в) не сместиться 8. Для смещения равновесия реакции а) увеличить концентрацию О2; в) повысить температуру б) увеличить концентрацию CS2; г) повысить давление 9. Химическое равновесие смещается за счет: а) изменения температуры процесса б) введения катализатора в) увеличение концентрации реагирующих веществ г) изменения давления 10. Изменение концентрации одного из реагирующих веществ в единицу времени в единице реакционного пространства, называется_______.
|
|||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1493; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.187.170 (0.014 с.) |



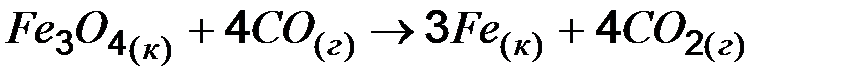
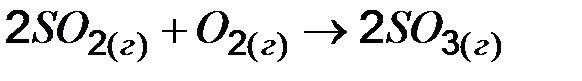
 =2, относительная скорость реакции
=2, относительная скорость реакции  .
. +830 кДж
+830 кДж -181 кДж
-181 кДж +172 кДж
+172 кДж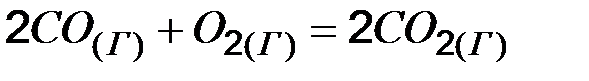 при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
при увеличении давления в системе в 2 раза? Температура системы поддерживается постоянной.
 , получаем, что
, получаем, что  .
.
 , следовательно, скорость реакции увеличится в 8 раз.
, следовательно, скорость реакции увеличится в 8 раз.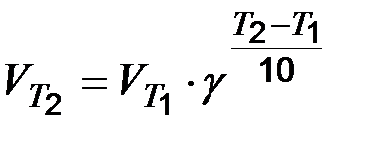
 определяем константу равновесия этой реакции:
определяем константу равновесия этой реакции:
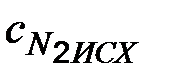 =2,5+1,8=4,3 моль/л. На образование 2 моль аммиака необходимо истратить 3 моль водорода, а для получения 3,6 молей аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л;
=2,5+1,8=4,3 моль/л. На образование 2 моль аммиака необходимо истратить 3 моль водорода, а для получения 3,6 молей аммиака требуется 3,6 ∙ 3/ 2 = 5,4 моль/л;  =1,8+5,4 =7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.
=1,8+5,4 =7,2 моль/л. Таким образом, реакция начиналась при концентрациях азота и водорода соответственно 4,3 и 7,2 моль/л.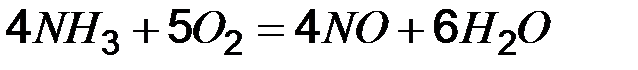 . Как изменится скорость реакции, если увеличить давление в 2 раза? Ответ: возрастет в 512 раз
. Как изменится скорость реакции, если увеличить давление в 2 раза? Ответ: возрастет в 512 раз
 концентрации были равны (моль/л): азота - 1,5; водорода - 2,5; аммиака - 0. Каковы концентрации азота и водорода при концентрации аммиака равной 0,5 моль/л? Ответ: 1,25 моль/м3; 1,75 моль/м3.
б) На сколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: 45,3 0C.
концентрации были равны (моль/л): азота - 1,5; водорода - 2,5; аммиака - 0. Каковы концентрации азота и водорода при концентрации аммиака равной 0,5 моль/л? Ответ: 1,25 моль/м3; 1,75 моль/м3.
б) На сколько нужно повысить температуру, чтобы скорость реакции возросла в 90 раз? Температурный коэффициент равен 2,7. Ответ: 45,3 0C.
 были равны (моль/м3): оксида углерода (II) - 0,05; паров воды - 0,06; оксида углерода (IV) - 0,4; водорода - 0,2. Вычислите концентрации всех реагирующих веществ, после того как прореагировало 60 % Н2О. Ответ: 0,24 моль/м3; 0,14 моль/м3; 0,76 моль/м3; 0,56 моль/м3.
б) Вычислите, при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент равен 3,2. Ответ: 304,9 К.
были равны (моль/м3): оксида углерода (II) - 0,05; паров воды - 0,06; оксида углерода (IV) - 0,4; водорода - 0,2. Вычислите концентрации всех реагирующих веществ, после того как прореагировало 60 % Н2О. Ответ: 0,24 моль/м3; 0,14 моль/м3; 0,76 моль/м3; 0,56 моль/м3.
б) Вычислите, при какой температуре реакция закончится за 45 минут, если при 293 К на это требуется 3 часа. Температурный коэффициент равен 3,2. Ответ: 304,9 К.
 . Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? Ответ: уменьшится в 16 раз.
б) Равновесие реакции, протекающей по уравнению
. Как изменится скорость реакции после разбавления реагирующей смеси в 4 раза? Ответ: уменьшится в 16 раз.
б) Равновесие реакции, протекающей по уравнению  , установилось при следующих концентрациях: [Н2]= 0,004 моль/л, [J2]= 0,025 моль/л, [HJ]= 0,08 моль/л. Определите константу равновесия этой реакции и исходные концентрации йода и водорода. Ответ: Кр= 64, 0,044 моль/л, 0,065 моль/л.
, установилось при следующих концентрациях: [Н2]= 0,004 моль/л, [J2]= 0,025 моль/л, [HJ]= 0,08 моль/л. Определите константу равновесия этой реакции и исходные концентрации йода и водорода. Ответ: Кр= 64, 0,044 моль/л, 0,065 моль/л.
 , если увеличить объем газовой смеси в 3 раза и предположить, что реакция протекает в соответствии с законом действующих масс? Ответ: уменьшится в 9 раз.
, если увеличить объем газовой смеси в 3 раза и предположить, что реакция протекает в соответствии с законом действующих масс? Ответ: уменьшится в 9 раз.
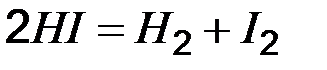 , если исходная концентрация HI составляет 0,55 моль/м3, а константа равновесия равна 0,12. Ответ: 0,11 моль/м3.
б) Реакция при температуре 50 0С протекает за 200 с. Температурный коэффициент данной реакции равен 2. За сколько времени закончится эта реакция при 70 0С? Ответ: за 50 с.
, если исходная концентрация HI составляет 0,55 моль/м3, а константа равновесия равна 0,12. Ответ: 0,11 моль/м3.
б) Реакция при температуре 50 0С протекает за 200 с. Температурный коэффициент данной реакции равен 2. За сколько времени закончится эта реакция при 70 0С? Ответ: за 50 с.
 , если концентрации всех реагирующих веществ уменьшить в 3 раза?
б) При наступлении равновесия реакции
, если концентрации всех реагирующих веществ уменьшить в 3 раза?
б) При наступлении равновесия реакции  при некоторой температуре установилось при концентрациях в моль/м3: [NO2]=0,06; [NO]=0,24; [O2]=0,12. Определите константу равновесия и рассчитайте исходную концентрацию NO2. Ответ: 1,92; 0,3 моль/м3.
б) На сколько градусов надо повысить температуру газообразной реакционной смеси, чтобы скорость реакции увеличилась в 125 раз, если температурный коэффициент равен 5? Ответ: на 30 0
при некоторой температуре установилось при концентрациях в моль/м3: [NO2]=0,06; [NO]=0,24; [O2]=0,12. Определите константу равновесия и рассчитайте исходную концентрацию NO2. Ответ: 1,92; 0,3 моль/м3.
б) На сколько градусов надо повысить температуру газообразной реакционной смеси, чтобы скорость реакции увеличилась в 125 раз, если температурный коэффициент равен 5? Ответ: на 30 0
 ,если константа равновесия при некоторой температуре равна 1 и для реакции было взято 1 моль углекислого газа и 3 моль водорода. Ответ: [H2] = 2,25; [ CO2] = 0,25; [CO] = 0,75; [H2O] = 0,75 моль/м3.
б) Как измениться скорость химической реакции
,если константа равновесия при некоторой температуре равна 1 и для реакции было взято 1 моль углекислого газа и 3 моль водорода. Ответ: [H2] = 2,25; [ CO2] = 0,25; [CO] = 0,75; [H2O] = 0,75 моль/м3.
б) Как измениться скорость химической реакции  ,если давление системы увеличить в 5 раз?
,если давление системы увеличить в 5 раз?
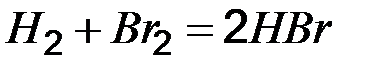 равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. Ответ:
равна 1. Определите состав равновесной смеси, если для реакции были взяты 1 моль водорода и 2 моль брома. Ответ:  = 0,55 моль.
= 0,55 моль.  = 1,55 моль.
= 1,55 моль.  = 0,90 моль.
б) Обратимая реакция протекает по уравнению:
= 0,90 моль.
б) Обратимая реакция протекает по уравнению:  . Равновесие установилось при следующих концентрациях участвующих в ней веществ: [NO]= 0,02 моль/л, [NО2]= 0,06 моль/л, [О2]= 0,3 моль/л. Определите константу равновесия и исходную концентрацию кислорода. Ответ: Кр= 30, 0,33 моль/л.
. Равновесие установилось при следующих концентрациях участвующих в ней веществ: [NO]= 0,02 моль/л, [NО2]= 0,06 моль/л, [О2]= 0,3 моль/л. Определите константу равновесия и исходную концентрацию кислорода. Ответ: Кр= 30, 0,33 моль/л.
 в)
в) 
 г)
г) 
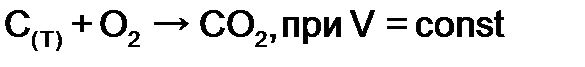 и увеличении количества реагентов в 4 раза возрастет в
и увеличении количества реагентов в 4 раза возрастет в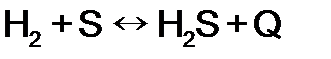
 вправо, необходимо:
вправо, необходимо:


