
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 10. Ионное произведение воды. Рн. Гидролиз солейСодержание книги
Поиск на нашем сайте Теоретические сведения
Вода – слабый электролит. Она полярна и находится в виде гидратированных кластеров. Благодаря тепловому движению связь разрывается, происходит взаимодействие: Н2О↔[Н3О]+*.пН2О + ОН-.рН2О Происходит самоионизация воды. Водородная связь превращается в ковалентную (по донорно-акцепторному механизму). Самоионизация (автопротолиз) воды – реакция переноса протона от одной молекулы к другой. 2Н2О↔Н3О+ +ОН- ΔдHо298=+56,5 кДж∙моль-1 Упрощенно процесс ионизации воды записывается как: Н2О↔Н+ + ОН-, однако истинные процессы эта реакция не изображает. Исходя из закона действующих масс можно записать константу равновесия этого процесса: Кд = На основании измерения электропроводности чистой воды было найдено, что хотя в 1л ее содержится Кд∙ [H2O] = [H+]∙[OH-] = 1,82∙10-16∙55,56 = 1,00∙10-14 = Кw Кw – ионное произведение воды, соnst для водных растворов. Кw - произведение концентраций ионов водорода и гидроксид иона при постоянной температуре есть величина постоянная и равна 10-14 в любом вводом растворе. Если [H+]=[OH-]=10-7 моль/дм3 – раствор нейтральный. рН=7 [H+]>[OH-] [H+]=10-1до 10-7моль/дм3 – раствор кислый. рН<7 [H+]<[OH-] [H+]=10-7до 10-14моль/дм3 – раствор щелочной. рН>7 В 1909 году Серенсен для обозначения концентраций [H+] и [OH-] ввел новые обозначения: -lg[H+]=рН – водородный показатель -lg[ОH-]=рОН – гидроксильный показатель Прологарифмировав уравнения расчета ионного произведения воды получаем: -lgKW = 14 = -lg[H+]+(-lg[ОH-]) pH + pOH = 14 pH = 14 - pOH Протекание различных химических процессов сильно зависит от реакции среды в растворе. Поэтому величина рН раствора является важнейшим показателем, который нужно контролировать. Определение рН имеет большое значение и в биохимии: все физиологические процесс происходят при определенной рН (пипсин, рН крови = 7,4, изменение хотя бы на 0,1 – смерть, рН слюны = 6,9, рН слез = 7). Методы определения рН: 1. химический 2. инструментальный Простейший способ контроля рН – применение индикаторов – веществ, окраска которых зависит от величины рН. По химической природе это слабые органические кислоты или основания и отличаются тем, что их молекулярной форме присуща окраска, не совпадающая с окраской их ионной формы: Н Инд↔Н+ + Инд- ИндОН↔ОН- + Инд+ Действие индикатора основано на смещении ионного равновесия в растворе слабого электролита. Для каждого индикатора существует диапазон рН (указывает среду), в котором наблюдается изменение окраски. Область перехода окраски каждого индикатора зависит от его константы диссоциации (табл. 50). Таблица 50 Изменение окраски некоторых индикаторов
Известны десятки разнообразных индикаторов как выпускаемых промышленностью, так и природных. Для точного определения рН применяют инструментальный метод с использованием приборов – иономеров (рН-метры) (рис. 33).
Согласно протеолитической теории рН и рОН связаны с константами кислотности и основности и концентрациями веществ: HA ↔H+ + A- Ka = B + H2O ↔ BH+ + OH- Kb = [H+] = √ Ka∙ c(1/z HA); [OH-] = √ Kb ∙ c(1/z B) pH = ½[pKa – lgc(1/z HA)] pOH = ½[pKb – lgc(1/zB)] pH = 14 + ½pKb + ½ lgc(1/zB)] Введение в раствор слабого электролита одноименных ионов уменьшает степень ионизации электролита (ионизация подавляется согласно принципу Ле-Шателье). С особым случаем влияния одноименных ионов встречаемся в так называемых буферных растворах. Буферный раствор состоит из слабой кислоты и соли, содержащей одинаковый с ней анион или из слабого основания и соли, содержащей тот же катион (табл. 51). Таблица 51 Примеры буферных растворов.
Такие смеси содержат большой резерв ионных и молекулярных частиц и поэтому обладают способностью поддерживать почти постоянное значение рН при добавлении в них небольших количеств сильной кислоты или сильного основания.
|
||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 423; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.225.55.104 (0.01 с.) |

 =
=  = 1,82∙10-16моль∙дм-3
= 1,82∙10-16моль∙дм-3 , на ионы распадается только 10-7 моль, поэтому концентрацию недиссоциированной воды принимаем за 55,56 моль.
, на ионы распадается только 10-7 моль, поэтому концентрацию недиссоциированной воды принимаем за 55,56 моль. Рис. 33. рН метр.
Рис. 33. рН метр.

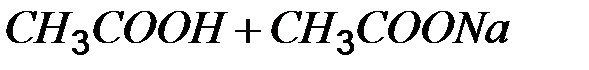 фосфатный буфер (рН 5,9-7,6)
фосфатный буфер (рН 5,9-7,6)  карбонатный буфер (рН 4,7 – 6,3)
Н2СО3 + NaHCO3
цитратный буфер (рН 1,1 – 4,9)
H3C6H5O7·NaOH
карбонатный буфер (рН 4,7 – 6,3)
Н2СО3 + NaHCO3
цитратный буфер (рН 1,1 – 4,9)
H3C6H5O7·NaOH
 боратный буфер (рН 8,1 – 10,1)Н3ВО3 + КН2ВО3
боратный буфер (рН 8,1 – 10,1)Н3ВО3 + КН2ВО3



