
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартные электродные потенциалы металловСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Он позволяет сделать ряд выводов относительно химических свойств элементов: 1. каждый элемент способен восстанавливать из растворов солей все ионы, имеющие большее значение стандартных электродных потенциалов. 2. величина стандартного электродного потенциала характеризует одновременно восстановительную способность атома и окислительную способность его ионов 3. Чем меньше величина стандартного электродного потенциала тем больше восстановительная способность атома и наоборот, тем меньше окислительная способность его иона 4. водород из разбавленных кислот может быть вытеснен только атомами, стандартные электродные потенциалы которых имеют знак минус.
Самостоятельно протекают ОВР, в которых восстановитель имеет более отрицательный электродный потенциал, чем окислитель. Знак и величина потенциала зависят от положения равновесия между металлом и раствором, природы металла, концентрации его ионов в растворе и температуры. Чем большей химической активностью обладает вещество, тем легче оно растворяется, тем в большей степени равновесие смещено вправо – тем отрицательнее потенциал. Переход ионов вещества в раствор происходит тем интенсивнее, чем меньше концентрация катионов в растворе. Наоборот, с увеличением концентрации раствора равновесие смещается влево, и потенциал становится более положительным. С повышением температуры потенциал становится более положительным, равновесие смещается влево. Ионы переходят в раствор – гидратация, а она процесс экзотермический (принцип Ле Шателье). Зависимость электродного потенциала от концентрации веществ, участвующих в ОВР, и от температуры выражается уравнением Нернста:
Окислителем всегда является полуэлемент с более высоким значением электродного потенциала, чем больше электродный потенциал, тем более сильным окислителем является окисленная форма, чем меньше электродный потенциал в данной системе, тем более сильным восстановителем является восстановленная форма. ОВР самопроизвольно протекает в сторону окислителя с меньшим значением стандартного электродного потенциала. Стандартный электродный потенциал является мерой окислительно-восстановительной способности в реакциях только в водных растворах. 3. ЭДС ОВР. Электродвижущая сила – разность электродных потенциалов окислителя и восстановителя. Это максимально возможная для данной системы разность потенциалов. Чем больше величина ЭДС, тем интенсивнее протекает ОВР.
ОВР протекает тогда, когда ЭДС>0. Направленность ОВ процесса определяется знаком ЭДС. Отрицательное значение ЭДС свидетельствует о том, что процесс слева направо протекать не может, реакция возможна только в обратном направлении. Стандартная ЭДС ОВР связана со стандартной энергией Гиббса, соотношением: где z – число электронов, принимающих участие в реакции, F – постоянная Фарадея. Стандартная энергия Гиббса связана с константой равновесия уравнением: Из этого соотношения по экспериментально определенному значению стандартной ЭДС можно вычислить константу равновесия соответствующей окислительно-восстановительной реакции:
где Т=298 К, R=8,31 Дж/моль·К, F=96500 Кл/моль. ОВР широко применяются в промышленности при производстве серной и азотной кислот, получении сажи, восстановлении металлов из руд, сжигании топлива. Коррозия металлов тоже ОВР, причиняющая огромные убытки. ОВР играют большую роль в биохимических процессах: дыхании, обмене веществ, нервной деятельности человека и животных.
6.2. Контрольные вопросы и задания 1. Электронная теория ОВР Писаржевского Л.В. 2. Степени окисления и правила их расчета. 3. Окислительно-восстановительная двойственность. 4. Механизм возникновения электродного потенциала 5. Стандартный электродный потенциал. Формула Нернста. 6. Гальванический элемент. Направленность окислительно-восстановительных процессов. 7. Составление уравнений ОВР методом полуреакций. 8. Влияние среды на ОВР. 9. Значение ОВР в биологических процессах.
Примеры решения задач Пример 1. Расставьте степени окисления элементов в представленной реакции. Уравняйте реакцию методом полуреакций, укажите окислитель, восстановитель, процессы окисления и восстановления. Рассчитайте молярные массы эквивалента окислителя и восстановителя. Найдите значения стандартных ЭДС, энергии Гиббса и константы равновесия реакции: Cu + HNO3 → Cu(NO3)2 + NO + H2O. Решение. Расставляем степени окисления: Cu0 + H+ + NO3- → Cu2+ + 2NO3- + N2+O2- + H+2O2-. Переписываем его в сокращенном виде с учетом частиц, которые участвуют в ОВР: Cu0 + H+ + NO3- → Cu2+ + N2+O2- + H+2O2-. Составляем схему процессов с учетом среды: Cu0 – 2е → Cu2+ - восстановитель, процесс окисления N5+O3- + 3е + 4H+ → N2+O2- + 2H2O – окислитель, процесс восстановления. Для составления общего уравнения реакции уравниваем число отданных и принятых электронов, складываем полуреакции с учетом коэффициентов: 3│Cu0 – 2е → Cu2+ 2│N5+O3- + 3е + 4H+ → N2+O2- + 2H2O 3Cu0 + 8H+ + 2NO3- → 3Cu2+ + 2NO +4 H2O Молекулярное уравнение имеет вид: 3Cu+8HNO3→3Cu(NO3)2 +2NO+4H2O МЭ (окислителя) = Мr(HNO3) / 3 = 63/3 = 21 г/моль; МЭ (восстановителя) = Мr(Cu) / 2 = 64/2 = 32 г/моль. ЭДС = Е0окислителя – Е0восстановителя Е0 (Cu0|Cu2+) = 0,34 (табл. величина) E0(NO3-| NO) = 0,96 (табл. величина) ЭДС = 0,96-0,34 = 0,62 В > 0, следовательно ОВР протекает в прямом направлении. Энергия Гиббса рассчитывается по формуле: ΔG0хр = - z· F · ЭДС = 6 · 96500 · 0,62 = - 358980 Дж = - 358,98 кДж. ΔG < 0, следовательно, процесс идет самопроизвольно. Находим константу равновесия при стандартных условиях: lgK = z·ЭДС /0,059 = 6· 0,62/0,059 = 63. Следовательно, Кр = 1·1063. Согласно константе равновесия (Кр > 1) ОВР смещается вправо, в сторону продуктов реакции. Пример 2. Установите, в каком направлении возможно самопроизвольное протекание реакции 2NaCl + Fe2(SO4)3 = 2FeSO4 + Cl2 + Na2SO4. Решение. Уравнение реакции в ионно-молекулярной форме имеет вид: 2Cl- + 2Fe+3 = 2Fe+2 + Cl2 Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5): Cl2 + 2e = 2Cl- E01 = 1,36 B; Fe+3 + e = Fe+2 Е02 = 0,77 В. Поскольку E01> Е02, то окислителем будет хлор, а восстановителем – ион Fe+2; рассматриваемая реакция протекает справа налево. Пример 3. Определить направление возможного самопроизвольного протекания реакции 2Hg + 2Ag+ = 2Ag + Hg2+2 при следующих концентрациях (моль/дм3) участвующих в реакции ионов: [Ag+] = 10-1, [Hg2+2] = 10-4. Решение. Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5): Hg2+2 + 2e = 2Hg E01 = 0,79 B; Ag+ + e = Ag E02 = 0,80 B, Вычисляем значения электродных потенциалов при указанных в условиях задачи концентрациях:
Поскольку Е1< Е2, то реакция протекает слева направо. Пример 4. Найдите при 250 С константу равновесия реакции: Hg2(NO3)2 + 2Fe(NO3)2 = 2Hg + 2Fe(NO3)3. Решение. Уравнение реакции в ионно-молекулярной форме имеет вид: Hg2+2 + 2Fe+2 = 2Hg + 2Fe+3 Находим стандартные электродные потенциалы электрохимических систем, участвующих в реакции (прил. 5): Hg2+2 + 2e = 2Hg E01 = 0,79 B - окислитель; Fe+3 + e = Fe+2 Е02 = 0,77 В - восстановитель. Находим значение стандартной ЭДС процесса ЭДС = E01 - Е02 = 0,79 – 0,77 = 0,02 В Вычисляем константу равновесия реакции:
6.4. Индивидуальные задания Задание 1. Определите степень окисления элементов вашего варианта в следующих соединениях (табл. 41). Таблица 41 Варианты контрольного задания
Продолжение табл. 41
Задание 2. Расставьте степени окисления элементов в представленной реакции. Уравняйте реакцию методом полуреакций, укажите окислитель, восстановитель, процессы окисления и восстановления. Рассчитайте молярные массы эквивалента окислителя и восстановителя. Найдите значения стандартных ЭДС, энергии Гиббса и константы равновесия реакции (табл. 42). Таблица 42 Исходные данные
6.5. Тестовые задания 1. Укажите степень окисления окислителя в реакции HCl + MnO2 = Cl2 + MnCl2 + H2O а) +2 б) -2 в) -1 г) +4 2. Название кислот, входящих в состав сильного окислителя «Царская водка» ………... 3. Название процесса отдачи электрона ……….. 4. Вещество, являющееся только восстановителем: а) S б) H2SO3 в) SO3 г) H2S 5. Вещество, являющееся только окислителем: а) H2SO4 б) H2O в) HNO2 г) Н2О2 6. Соединение, способное проявлять окислительно-восстановительные свойства: а) H2S б) H2SO4 в) H2SO3 г) SO3 7. Продукт полного восстановления азотной кислоты: а) NO2 б) NO в) NH3 г) N2O 8. При образовании хлорида аммония NH3 + HCl = NH4Cl изменяется а) степень окисления азота в) степень окисления водорода б) степень окисления хлора г) валентность атома азота 9. Степень окисления хлора в Са(ClO)2 равна: а) +1 б) +3 в) +5 г) +7 10. Среди перечисленных реакций: 1. KOH + HCl = KCl + H2O 2. CuO + H2 = Cu + H2O 3. Fe + H2O + O2 = Fe(OH)3 4. CuO + H2SO4 = CaSO4 к окислительно-восстановительным относятся а) 1, 2 б) 2, 3 в) 3, 4 г) 1, 4
ТЕМА 7. ЛИГАНДООБМЕННЫЕ РАВНОВЕСИЯ И ПРОЦЕССЫ. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Теоретические сведения Многие ионы способны присоединять к себе молекулы или противоположные ионы и превращаться в более сложные ионы, называемые комплексными. Комплексные соединения (КС) – это соединения в узлах кристаллов которых находятся комплексные ионы, способные к самостоятельному существованию в растворе. В формулах КС комплексные ионы заключают в квадратные скобки. CoCl3 + 6NH3 = [Co(NH3)6]Cl3 Со3+ + 6NH3 = [Co(NH3)6]3+ CuSO4 +4NH3 = [Cu(NH3)4] SO4 Cu2+ + 4NH3 = [Cu(NH3)4]2+ 3KCN + Fe(CN)3 = K3[Fe(CN)6] 3CN- + Fe(CN)3 = [Fe(CN)6]3- Причиной комплексообразования является электростатическое и донорно-акцепторное взаимодействие между ионами, между ионами и молекулами, между молекулами.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 1483; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.009 с.) |



 →
→ 
 (60)
(60)
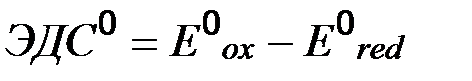 (61)
(61) , (62)
, (62)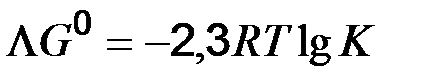 = -
= - 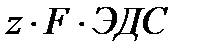
 (63)
(63)





