
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Систематические и международные названия некоторых сложных веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Приставки орто- и мета- применяют, чтобы различать названия кислот, молекулы которых отличаются только «содержанием воды».
Для высшей или единственной степени окисления применяют суффиксы -н-, -ов-, -ев-:
Если возможны две степени окисления, то для низшей используют суффиксы -ист-, -овист-: В случае трех возможных степеней окисления кислотообразующего элемента, помимо упомянутых суффиксов, для самой низкой (обычно +1) применяется составной суффикс -новатист-:
В названиях кислот с четырьмя различными степенями окисления последовательно используют суффиксы -н-, -новат-, -ист- и -новатист-:
Для того чтобы различить кислоты, содержащие разное количество атомов кислотообразующего элемента в одной степени окисления, применяют числовые приставки:
Систематические названия кислот составляется так, будто кислота – соль водорода: H2SO4 тетраоксосульфат(VI) водорода, H2CO3 триоксокарбонат(IV) водорода. Но для наиболее известных кислот номенклатурные правила допускают применение их тривиальных названий, которые вместе с названиями соответствующих анионов приведены в табл. 12. Пероксокислоты получаются при замещении оксид-иона (О2-) в молекуле оксокислоты пероксид-ионом (О22-). Чтобы назвать их, к тривиальному названию оксокислоты роибавляется префикс пероксо -: Таблица 12 Названия наиболее распространенных кислот и их анионов
Тиокислоты получаются при замещении оксид-ионов в молекуле оксокислоты сульфид-ионом. К названию оксокислоты прибавляется префикс тио-: H2S2O3 – тио серная кислота (соли – тиосульфаты), H3AsS3 – тио мышьяковистая кислота (соли – тиоарсениты), H3AsS4 – тио мышьяковая кислота (соли – тиоарсенаты), HSNC – тио цианистая кислота (соли - тиоцианаты), H2S4O6 – тетра тио новая кислота (соли – тетратионаты). Основания Согласно международной номенклатуре названия оснований составляются из слова гидроксид и названия металла. Например, Помимо этих названий для некоторых наиболее важных оснований применяются и другие. Например, гидроксид натрия
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 520; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.140.188.195 (0.006 с.) |


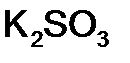
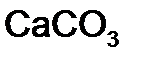
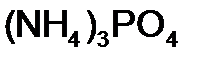
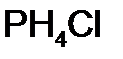

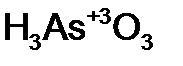 - орто мышьяковистая кислота;
- орто мышьяковистая кислота;  - мета мышьяковистая кислота
- мета мышьяковистая кислота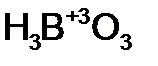 - бор н ая кислота;
- бор н ая кислота; 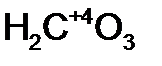 - уголь н ая кислота;
- уголь н ая кислота;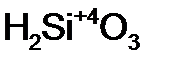 - кремни ев ая кислота;
- кремни ев ая кислота; 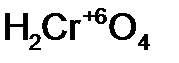 - хром ов ая кислота;
- хром ов ая кислота;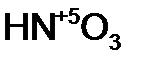 - азот н ая кислота;
- азот н ая кислота; 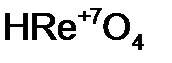 - рени ев ая кислота;
- рени ев ая кислота; - метафосфор н ая кислота;
- метафосфор н ая кислота; 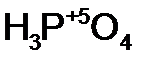 - ортофосфор н ая кислота.
- ортофосфор н ая кислота. - селен ист ая кислота;
- селен ист ая кислота; 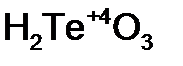 - теллур ист ая кислота.
- теллур ист ая кислота.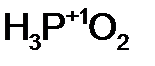 - фосфорн оватист ая кислота;
- фосфорн оватист ая кислота;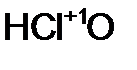 - хлорнов атист ая кислота.
- хлорнов атист ая кислота.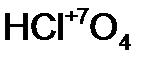 - хлор н ая кислота;
- хлор н ая кислота; 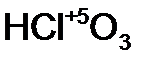 - хлор новат ая кислота;
- хлор новат ая кислота;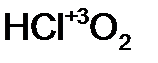 - хлор ист ая кислота;
- хлор ист ая кислота; 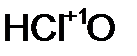 - хлорн оватист ая кислота.
- хлорн оватист ая кислота. - ди хромовая кислота;
- ди хромовая кислота; 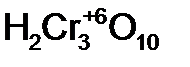 - три хромовая кислота;
- три хромовая кислота; - ди сернистая кислота;
- ди сернистая кислота; 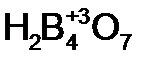 – тетра борная кислота.
– тетра борная кислота. - пероксо серная кислота (соли – пероксосульфаты), H2S2O3 – пероксо дисерная кислота (соли – пероксодисульфаты), H2CrO5 – ди пироксо хромовая кислота (соли – дипироксохроматы).
- пероксо серная кислота (соли – пероксосульфаты), H2S2O3 – пероксо дисерная кислота (соли – пероксодисульфаты), H2CrO5 – ди пироксо хромовая кислота (соли – дипироксохроматы).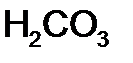
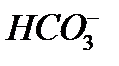
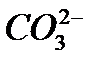

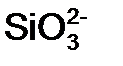

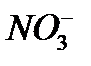


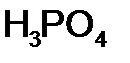

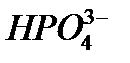




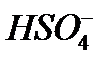


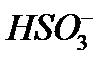
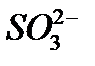


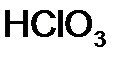
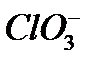




 - гидроксид натрия,
- гидроксид натрия, 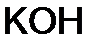 - гидроксид калия,
- гидроксид калия,  - гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках:
- гидроксид кальция. Если элемент образует несколько оснований, то в названиях указывается степень его окисления римской цифрой в скобках:  - гидроксид железа (II),
- гидроксид железа (II),  - гидроксид железа (III).
- гидроксид железа (III). - едкий барий.
- едкий барий.


