
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Тема 4. Химическая кинетика. Термодинамика химического равновесияСодержание книги
Поиск на нашем сайте Теоретические сведения Кинетика химических реакций - учение о химических процессах, о законах их протекания во времени, скоростях и механизмах. С исследованиями кинетики химических реакций связаны важнейшие направления современной химии и химической промышленности: разработка рациональных принципов управления химическими процессами; стимулирование полезных и торможение и подавление нежелательных химических реакций; создание новых и усовершенствование существующих процессов и аппаратов в химической технологии; изучение поведения химических продуктов, материалов и изделий из них в различных условиях применения и эксплуатации. Скоростью химической реакции называют изменение количества вещества в единицу времени в единице реакционного пространства. Различают гомогенные и гетерогенные реакции. Если вещества находятся в одной фазе, то такая реакция – гомогенная, если в разных фазах – гетерогенная. Скорость гомогенной реакции , где Скорость реакции в СИ имеет единицу измерения [моль/м3×с], однако также используются и другие единицы измерения [моль/л×с], [моль/см3×с], [моль/см3×мин]. Скорость реакции зависит от многих факторов. На нее влияют природа и концентрация реагентов, давление (для реакций с участием газов), температура, катализатор, примеси и их концентрации, степень измельчения (в реакциях с участием твердых веществ), среда (для реакций в растворах), форма сосуда (для цепных реакций), интенсивность света (для фотохимических реакций), потенциал электродов (для электрохимических реакции), мощность дозы излучения (для радиационно-химических процессов). Основными параметрами, которые приходится учитывать при изучении кинетики процессов, являются природа реагирующих веществ, концентрации (давления) реагентов, температура и действие катализатора. Природа реагирующих веществ о пределяется типом химических связей и строением молекул. Реакция протекает в направление разрушения менее прочных связей и образования вещества с более прочными связями. Влияние концентрации на скорость реакций. Чтобы осуществлялось химическое взаимодействие веществ А и В, их молекулы (частицы) должны столкнуться. Чем больше столкновений, тем быстрее протекает реакция. Число же столкновений тем больше, чем выше концентрация реагирующих веществ. Отсюда на основе обширного экспериментального материала сформулирован основной закон химической кинетики открытый в 1864-1867 гг. Гульдбергом и Вааге (Норвегия) (закон действующих масс), устанавливающий зависимость скорости реакции от концентрации реагирующих веществ. Закон действующих масс (ЗДМ ): скорость элементарной реакции пропорциональна произведению концентраций реагирующих веществ в степенях, равных стехиометрическим коэффициентам. Для реакции аА + вВ = сС + dD этот закон выразится уравнением:
где Из уравнения нетрудно установить физический смысл константы скорости Уравнение, связывающее скорость реакции с концентрацией реагирующих веществ, называется кинетическим уравнением реакции. Если опытным путем определено кинетическое уравнение реакции, то с его помощью можно вычислять скорости при других концентрациях тех же реагирующих веществ. Молекулярность и порядок реакций. В химической кинетике реакции классифицируются по двум параметрам: по молекулярности и по порядку реакции. Число молекул, участвующих в элементарном акте химического взаимодействия, называется молекулярностью (М) реакции. По этому параметру различают реакции мономолекулярные, бимолекулярные и т. д. Вероятность одновременного соударения многих частиц очень мала, поэтому тримолекулярные реакции редки, а четырехмолекулярные вообще неизвестны. Для тримолекулярных элементарных реакций, когда реагируют одна молекула А и две молекулы В, уравнение закона действия масс имеет вид:
Сумма показателей степеней в кинетических уравнениях называется общим (суммарным) порядком реакции (n). Таким образом, порядок реакции определяет характер зависимости скорости от концентрации реагентов. Для элементарных реакций молекулярность и порядок реакции совпадают. Если процесс многостадиен, запись уравнения реакции лишь фиксирует исходное и конечное состояние системы, не раскрывая механизма процесса, порядки реакции по реагентам, как правило, не совпадают со стехиометрическими коэффициентами, а общий порядок реакции не равен сумме стехиометрических коэффициентов, то в этом случае для расчета скорости используют основное кинетическое уравнение:
где В случае гетерогенной реакции реакционным пространством можно считать поверхность раздела фаз, и скорость реакции первого порядка описывается уравнением:
где Так же для гетерогенных реакций скорость зависит от скорости подвода реагента и от скорости удаления продуктов реакции из реакционного пространства.
|
||
|
Последнее изменение этой страницы: 2016-08-26; просмотров: 455; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.006 с.) |

 определяется изменением концентрации одного из реагирующих веществ в единицу времени:
определяется изменением концентрации одного из реагирующих веществ в единицу времени: (40)
(40) , изменение концентрации вещества, знак (+), если скорость определяется по изменению концентрации продуктов реакции, знак (-), если скорость оценивается по убыли концентрации одного из исходных веществ.
, изменение концентрации вещества, знак (+), если скорость определяется по изменению концентрации продуктов реакции, знак (-), если скорость оценивается по убыли концентрации одного из исходных веществ. , (41)
, (41) и
и  - концентрации веществ А и В, моль/дм3;
- концентрации веществ А и В, моль/дм3;  - коэффициент пропорциональности, называемый константой скорости реакции.
- коэффициент пропорциональности, называемый константой скорости реакции. : она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/дм3 или когда их произведение равно единице. Константа скорости реакции зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций.
: она численно равна скорости реакции, когда концентрации каждого из реагирующих веществ составляют 1 моль/дм3 или когда их произведение равно единице. Константа скорости реакции зависит от природы реагирующих веществ и от температуры, но не зависит от их концентраций. (42)
(42) , (43)
, (43) и
и  ‑ коэффициенты, называемые порядками реакции по веществам A и В.
‑ коэффициенты, называемые порядками реакции по веществам A и В.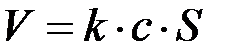 (44)
(44) - концентрация реагента (газообразного или жидкого),
- концентрация реагента (газообразного или жидкого),  - площадь поверхности (м2).
- площадь поверхности (м2).


