
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодический закон и периодическая системаСодержание книги
Поиск на нашем сайте
ТИПОВЫЕ АТТЕСТАЦИОННЫЕ ЗАДАНИЯ ПО ХИМИИ
Учебно-методическое пособие
Под редакцией профессора Ю.И. Рябухина
Астрахань УДК 54 (075.8) ББК 24.1в644я73 Т 43 Типовые аттестационные задания по химии: Учебно-методическое пособие / Рябухин Ю.И., Лебедева А.П., Старкова Н.Н., Шавель И.И., Огородникова Н.П., Глинина Е.Г., Каламбетова Л.С., Севостьяненко Л.А. / Под ред. доктора хим. наук Ю.И. Рябухина. – Астрахань: Астрахан. гос. техн. ун-т, 2013. – 128 с.
Пособие содержит типовые тестовые задания для текущей и итоговой аттестации. Задания составлены по основным разделам курса химии в соответствии с рекомендациями федеральных государственных образовательных стандартов высшего профессионального образования для студентов нехимических направлений. Может служить пособием для лиц, самостоятельно изучающих основы химии, для учащихся общеобразовательных учреждений и средних специальных учебных заведений химического профиля, а также использовано преподавателями и методистами, применяющими в своей работе тестовый способ контроля знаний.
Рецензент: доктор химических наук, декан химического факультета, заведующий кафедрой "Неорганической и биоорганической химии" Астраханского государственного университета Тырков А.Г.
Печатается по решению кафедры "Общая, неорганическая и аналитическая химия". Протокол № 4 от 18.04.2013 г.
© Рябухин Ю.И., Лебедева А.П., Старкова Н.Н., Шавель И.И., Огородникова Н.П., Глинина Е.Г., Каламбетова Л.С., Севостьяненко Л.А., 2013 © Астраханский государственный технический университет, 2013
Если у тебя появится желание проверить свои знания по химии, это можно легко и надёжно сделать при помощи тестов. Тесты не только помогают реализовать самоконтроль, но и позволяют самостоятельно совершенствовать знания. Тест (от англ. test – испытание) – это одна из мотивационных форм контроля знаний, поскольку успехи обучающихся примерно на 70 % обусловлены мотивацией и на 30 % – способностями. Педагогический тест анализирует не способности, а измеряет уровень усвоения определённых знаний. Успех на тестировании могут гарантировать только систематические и упорные занятия, поэтому не стремись сразу смотреть ответы, внимательно изучи тестовое задание, попробуй самостоятельно его выполнить и только для самоконтроля воспользуйся ответом. В данном пособии приведены тестовые задания, цель которых помочь тебе подготовиться к итоговой аттестации по химии. Выборочный тип ответа предполагает наличие в каждом наборе вариантов ответов одного правильного (иногда больше). Задание считается выполненным верно, если выбран номер правильного ответа (или всех правильных ответов). При работе над тестом надо вдумчиво читать задания, которые в лаконичной форме содержат достаточную информацию для того, чтобы правильно их выполнить. Для выполнения заданий, включённых в тест, следует грамотно применять теоретические положения химии. Задания, требующие формулировки какого-либо закона, принципа или правила, в тесты могут не включаться, однако их знание необходимо использовать при решении задач, записи уравнений химических реакций и схем, в выборе ответов. Одной из причин неправильных ответов является невнимательное прочтение текстов заданий и вариантов ответов. Авторы надеются, что настоящее пособие не только позволит тебе систематизировать знания по химии, но и повысит твой интеллект как будущего специалиста с высшим образованием. Пусть изучение химии для тебя будет интересным и полезным, а приобретаемые знания помогут в достижении твоих профессиональных целей.
Успеха тебе!
От имени авторов Соросовский профессор Рябухин Ю.И
КЛАССИФИКАЦИЯ И СВОЙСТВА НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ 1. С кислотами и щелочами взаимодействует оксид …. 1) магния 2) хрома(II) 3) хрома(VI) 4) хрома(III)
2. Все вещества реагируют между собой в группе …. 1) ВаО, МgО, СuО 2) НСl, НВr, НI 3)
3. Кислота образуется при растворении в воде оксида …. 1)
4. Взаимодействие азотной кислоты с металлами происходит без образования …. 1) оксида азота 2) водорода 3) воды 4) соли
5. Растворы щелочей реагируют с …. 1) Mg 2) C 3) Zn 4) N2
6. Соль образуется при …. 1) горении порошка железа в хлоре 2) разложении пероксида водорода 3) взаимодействия негашёной извести с водой 4) обугливании сахара в серной кислоте
7. Амфотерным является гидроксид …. 1) бария 2) цинка 3) лития 4) хрома(III)
8. При взаимодействии оксидов с водой могут быть получены …. 1)
9. Со щелочами взаимодействует оксид …. 1) хрома(III) 2) железа(II) 3) серы(IV) 4) азота(II)
10. Оксид цинка не реагирует с …. 1) 11. Кислотным является оксид …. 1) Zn 2) Сr(III) 3) Мn(VII) 4) Сu(II)
12. Оснóвные свойства проявляет …. 1) ZnО 2)
13. В цепочке превращений
конечным веществом является …. 1) Fе(ОН)3 2) FеО 3)
14. В ряду превращений
конечным веществом является …. 1) FеО 2) Fе(ОН)2 3)
15. В цепочке превращений
веществом Х2 является …. 1)
16. В ряду превращений
химическим соединением Х2 является …. 1)
17. В цепочке превращений
конечным веществом является …. 1)
18. В цепочке превращений
конечным веществом является …. 1)
19. В правой части схемы реакции
пропущены химические формулы …. 1)
20. В схеме реакции
отсутствуют химические формулы …. 1) KOCl 2) KH 3) KCl 4) KOH
21. В схеме реакции
пропущены химические формулы …. 1)
22. В правой части схемы реакции
отсутствуют химические формулы …. 1) 3)
23. В схеме реакции
пропущены химические формулы …. 1)
24. Для цепочки превращений
веществом Х является …. 1)
25. В схеме реакции
пропущены химические формулы …. 1)
26. В схеме реакции
пропущены химические формулы …. 1)
27. В схеме реакции СаСО3 + … + Н2О → … отсутствуют химические формулы …. 1) Са(ОН)2 2) Са(НСО3)2 3) СО2 4) СО
28. В схеме реакции
пропущены химические формулы …. 1) 3)
29. В схеме реакции
отсутствуют химические формулы …. 1) СаО 2)
30. В схеме реакции
пропущены химические формулы …. 1) AlOHS 2)
ОСНОВНЫЕ ПОНЯТИЯ И ЗАКОНЫ ХИМИИ
1. Масса нитрата магния, равная 7,4 г, соответствует количеству вещества … моль. 1) 1 2) 0,1 3) 0,05 4) 0,5
2. Объём оксида серы(IV), равный 224 л (н. у.), соответствует количеству вещества … моль. 1) 15 2) 5 3) 1 4) 10
3. Масса 10 моль азотной кислоты равна … г. 1) 63 2) 630 3) 315 4) 31,5
4. Объём 5 моль хлора при н. у. равен … л. 1) 14,2 2) 355 3) 112 4) 44,8
5. Объём 20 г оксида углерода(II) при н. у. равен … л. 1) 25 2) 16 3) 31 4) 0,7
6. Масса 5,6 л кислорода при н. у. равна … г. 1) 32 2) 16 3) 8 4) 4
7. Молярная (мольная) масса – это масса …. 1) одной молекулы 2) одного моля структурных единиц 3) одного литра газа 4) вещества, умноженная на его количество 8. Молярный (мольный) объём, равный при н. у. 22,4 л/моль, – это объём …. 1) одной молекулы 2) одного моля твёрдого вещества 3) одного моля жидкого вещества 4) одного моля газообразного вещества
9. Согласно закону сохранения массы …. 1) вещества реагируют в количествах, пропорциональных их эквивалентам 2) масса исходных веществ уменьшается в процессе реакции 3) массы веществ, вступивших в реакцию и образовавшихся в результате реакции, равны 4) масса продуктов реакции увеличивается в процессе реакции
10. Эквивалент фосфора в фосфине РН3 равен … его атома. 1)
11. Эквивалентом вещества называется такая его частица (реальная или условная), которая взаимодействует без остатка с …. 1) молем молекул кислорода 2) эквивалентом другого вещества 3) молем атомов кислорода 4) молем молекул водорода
12. Эквивалент серной кислоты может быть равен … 1) 1 и 2 2) 2 3) 0,5 и 2 4) 0,5 и 1
13. Молярная масса эквивалента (эквивалентная масса) хрома в хромате калия К2СrО4 равна … г/моль. 1) 8,7 2) 17,3 3) 52 4) 26
14. Эквивалентная масса оксида равна …. 1) его молярной массе, делённой на число атомов кислорода в формуле оксида 2) его молярной массе, делённой на сумму валентностей атомов кислорода и элемента, образующего оксид 3) сумме эквивалентных масс атомов кислорода и элемента, образующего оксид 4) сумме масс элемента и кислорода
15. Эквивалентная масса оксида равна его …. 1) мольной массе, делённой на произведение валентности и числа атомов кислорода 2) молярной массе, делённой на сумму валентностей атомов кислорода и элемента, образующего оксид 3) молярной массе, делённой на сумму валентности атома элемента, образующего оксид, и числа атомов кислорода 4) мольной массе, делённой на произведение валентности атома кислорода и числа атомов элемента, образующего оксид
16. Эквивалентная масса кислородсодержащей кислоты равна …. 1) её молярной массе, делённой на кислотность 2) её молярной массе, делённой на валентность кислорода 3) сумме эквивалентных масс атома водорода и кислотного остатка 4) сумме эквивалентных масс атомов водорода, кислорода и кислотообразующего элемента
17. Эквивалентная масса основания равна …. 1) его молярной массе, делённой на сумму степени окисления атома металла, образующего основание, и числа гидроксогрупп 2) молярной массе этого основания, делённой на его основность 3) молярной массе этого основания, делённой на его кислотность 4) сумме эквивалентных масс атомов металла, водорода и кислорода
18. Эквивалентная масса соли равна …. 1) произведению эквивалентных масс катиона и аниона 2) сумме эквивалентных масс катиона и аниона 3) её молярной массе, делённой на сумму анионов и степени окисления атома металла 4) её молярной массе, делённой на сумму степени окисления и числа атомов металла
19. Эквивалентная масса восстановителя равна …. 1) его молярной массе, делённой на число принятых электронов 2) эквивалентной массе окислителя 3) его молярной массе, делённой на число отданных электронов 4) молярной массе восстановителя, делённой на количество вещества
20. Эквивалентная масса окислителя равна …. 1) эквивалентной массе восстановителя 2) его молярной массе, делённой на число отданных электронов 3) молярной массе окислителя, делённой на количество вещества 4) его мольной массе, делённой на число принятых электронов
21. Эквивалентная масса оксида марганца(VII) равна … г/моль. 1) 24,6 2) 110,9 3) 15,9 4) 31,7
22. Количество вещества эквивалента Н2SО4, равное 0,2 моль, соответствует массе … г. 1) 9,8 2) 19,6 3) 245 4) 490
23. Масса 13 г Аl(ОН)3 соответствует количеству вещества его эквивалента, равному … моль. 1) 0,17 2) 0,5 3) 78 4) 26
24. Эквивалентная масса Fе(ОН)3, вступающего в реакцию с 1 моль НNО3, равна … г/моль. 1) 107 2)
25. Эквивалентная масса Н2S, вступающего в реакцию с 1 моль КОН, равна … г/моль. 1) 34 2) 17 3) 16 4) 32
26. Эквивалентный объём газообразного вещества равен …. 1) произведению эквивалентной массы и молярного объёма 2) объёму, который занимает при н. у. 1 моль этого вещества, делённому на сумму эквивалентных масс атомов составляющих его элементов 3) объёму, который занимает при н. у. 1 моль эквивалентов этого вещества 4) произведению эквивалентной и молярной масс, делённому на молярный объём
27. Эквивалентный объём оксида серы(IV) при н. у. равен … л/моль. 1) 5,6 2) 2,8 3) 11,2 4) 22,4
28. Математическое выражение закона эквивалентов имеет вид …. 1) mА · Мэк (А) = mВ · Мэк (В) 2) 3) nэк (А) = nэк (В) 4) Мэк =
29. Закон эквивалентов выражается математическим уравнением …. 1) nэк (А) = nВ 2) 3)
30. Закону эквивалентов соответствует уравнение …. 1) mА · Мэк (В) = mВ · Мэк (А) 2) nэк (А) = nВ
3)
СТРОЕНИЕ ВЕЩЕСТВА СТРОЕНИЕ АТОМА 1. Главное квантовое число характеризует …. 1) общий запас энергии электрона в атоме 2) номер энергетического уровня атома 3) орбитальный момент импульса электрона 4) собственный момент импульса электрона
2. Орбитальное (или побочное, или азимутальное) квантовое число характеризует …. 1) момент импульса электрона при его движении вокруг атомного ядра 2) число атомных орбиталей на энергетическом подуровне 3) тип атомных орбиталей 4) размеры атомной орбитали
3. Магнитное квантовое число характеризует …. 1) проекцию орбитального момента количества движения электрона на направление внешнего поля 2) проекцию орбитального момента импульса электрона на направление электрического или магнитного поля 3) "движение электрона вокруг своей оси" 4) энергетический подуровень
4. Спиновое квантовое число характеризует …. 1) спин электрона 2) число подуровней на данном энергетическом уровне атома 3) внутреннее (орбитальное) движение электрона 4) орбитальный момент количества движения электрона
5. Форму атомной орбитали характеризует квантовое число …. 1) l 2) m l 3) ms 4) n
6. Размеры атомной орбитали характеризует квантовое число …. 1) l 2) m l 3) ms 4) n
7. Ориентацию атомной орбитали относительно направления электрического или магнитного поля характеризует квантовое число …. 1) l 2) m l 3) ms 4) n
8. Собственный момент количества движения электрона характеризует квантовое число …. 1) l 2) m l 3) ms 4) n
9. Максимальное количество электронов на третьем энергетическом уровне равно …. 1) 2 2) 8 3) 18 4) 32
10. Количество подуровней на третьем энергетическом уровне равно …. 1) 1 2) 2 3) 3 4) 4
11. Количество орбиталей на третьем энергетическом уровне равно …. 1) 1 2) 4 3) 9 4) 16
12. Электронная конфигурация нейтральных атомов с зарядом ядра +23 в основном состоянии выражается формулой …. 1) 1s22s22р63s23р63d24s3 2) 1s22s22р63s23р63d44s1 3) 1s22s22р63s23р63d54s0 4) 1s22s22р63s23р63d34s2
13. Атомный номер элемента, валентные электроны атомов которого в основном состоянии описываются формулой 3s23р4, равен …. 1) 8 2) 10 3) 11 4) 16
14. Количество электронов в нейтральном атоме азота, у которых m l = 0, равно …. 1) 3 2) 6 3) 5 4) 7
15. Количество электронов в нейтральном атоме фосфора, у которых m l = +1, равно …. 1) 3 2) 6 3) 9 4) 15
16. Количество электронов в нейтральном атоме марганца, у которых m l = –2, равно …. 1) 1 2) 5 3) 13 4) 25
17. Атом иода в основном состоянии описывается сокращённой электронной формулой …. 1) [Kr]5s25p55d5 2) [Kr]5s25р5 3) [Kr]5s25р4 4) [Kr] 5s24d105р5
18. В атомах олова в основном состоянии валентные электроны описываются формулой…. 1) 5s25р2 2) 5d25р2 3) 5s24d105р3 4) 5s25d105р2
19. Распределение электронов по энергетическим уровням в невозбуждённом атоме магния описывается набором цифр …. 1) 4, 6, 2 2) 2, 6, 4 3) 2, 8, 2 4) 2, 8, 4
20. Невозможной для атомов является электронная конфигурация …. 1) 2р1 2) 3s2 3) 2d4 4) 4f 3
21. Количество электронов на внешнем энергетическом уровне нейтрального атома хлора в нормальном состоянии равно …. 1) 5 2) 6 3) 7 4) 8
22. Количество электронов на р-подуровне внешнего энергетического уровня нейтрального атома брома в основном состоянии равно …. 1) 4 2) 5 3) 6 4) 7
23. Заряд ядра нейтральных атомов, описываемых сокращённой электронной формулой [Ar] 4s13d5, равен …. 1) +20 2) +24 3) +30 4) +34
24. Количество заполненных энергетических подуровней в нейтральном невозбуждённом атоме германия равно …. 1) 5 2) 6 3) 7 4) 8
25. Количество заполненных энергетических уровней в нейтральном атоме кальция в основном состоянии равно …. 1) 4 2) 3 3) 2 4) 1
26. Химический элемент, в нейтральных атомах которого на энергетическом М - уровне содержится 9 электронов, – это …. 1) калий 2) скандий 3) кальций 4) медь
27. Элемент четвёртого периода Периодической системы химических элементов Д.И.Менделеева, нейтральные атомы которого имеют на d-подуровне по 3 электрона, – это …. 1) Мn 2) V 3) Sс 4) Сr
28. Количество электронов на s-орбиталях нейтрального атома магния в основном состоянии равно …. 1) 2 2) 6 3) 8 4) 12
29. Максимальное количество неспаренных электронов на любом р-подуровне атомов химических элементов равно …. 1) 3 2) 4 3) 5 4) 6
30. Количество неспаренных электронов в нейтральном атоме кобальта в нормальном состоянии равно …. 1) 2 2) 3 3) 4 4) 5
31. Порядок размещения электронов в невозбуждённых атомах кислорода изображаются схемами …
32. р-Элемент, нейтральные атомы которого в основном состоянии содержат наибольшее число вакантных орбиталей, – это …. 1) Аl 2) Si 3) Р 4) S
33. Возбуждённое состояние атомов магния описывается сокращённой электронной формулой …. 1) [Nе] 3s2 2) [Nе] 3s13р2 3) [Nе] 3s13р1 4) [Nе] 3s23р1
34. Суммарный спин электронов нейтрального невозбуждённого атома марганца равен …. 1)
35. Схема расположения электронов в нейтральных атомах серы в основном состоянии имеет вид ….
36. Суммарный спин электронов нейтрального невозбуждённого атома германия равен …. 1)
37. Количество заполненных энергетических подуровней во фторид-анионе равно …. 1) 1 2) 2 3) 3 4) 4
38. Анионы брома в основном состоянии описываются электронной формулой …. 1) 1s22s22р63s23р63d104s24р6 2) 1s22s22р63s23р63d104s24р4 3) 1s22s22р63s23р63d104s24р5 4) 1s22s22р63s23р63d104s1
39. Катионы цинка в нормальном состоянии описываются электронной формулой …. 1) 1s22s22р63s23р63d10 2) 1s22s22р63s23р63d84s2 3) 1s22s22р63s23р63d104s24р2 4) 1s22s22р63s23р63d104s2
40. Наибольшее количество электронов имеет …. 1) нейтральный атом натрия 2) положительно заряженный атом алюминия 3) отрицательно заряженный атом фтора 4) нейтральный атом магния
41. Электронную оболочку невозбуждённых нейтральных атомов одного из благородных газов имеют ионы …. 1) Са2+ 2) Сr3+ 3) Sn2+ 4) Мn2+
42. Частицами, имеющими такую же электронную конфигурацию, как и невозбуждённые атомы аргона, являются …. 1) ионы кальция 2) электронейтральные атомы калия 3) нейтральные атомы хлора 4) ионы натрия
43. Количество электронов в анионе серы равно …. 1) 14 2) 16 3) 18 4) 21
44. Согласно правилу Клечковского, …. 1) в атоме не может быть двух электронов с одинаковым набором квантовых чисел 2) 3d-подуровень заполняется электронами после 4s-подуровня 3) на 2р-подуровне не может быть больше шести электронов 4) суммарный спин электронов энергетического подуровня максимален
45. Количество нейтронов в атомах изотопов 1) 1,2,3 2) 2,3,4 3) 0,1,2 4) 1,1,1
46. Количество нейтронов в атомах нуклида 1) 52 2) 24 3) 28 4) 76
47. Количество нуклонов а атомах нуклида 1) 79 2) 118 3) 197 4) 276 48. Количество протонов в атомах нуклида марганца-55 равно …. 1) 20 2) 25 3) 80 4) 55
49. На энергетическом подуровне атома, характеризующимся орбитальным квантовым числом 2, максимально может находиться … электронов. 1) 2 2) 8 3) 10 4) 14
50. Промежуток времени, в течение которого происходит распад половины радиоактивных атомов химического элемента, называется …. 1) временем распада 2) характеристическим временем 3) периодом разложения 4) временем полураспада
ХИМИЧЕСКАЯ СВЯЗЬ
1. В молекуле азота валентность атомов …. 1) равна степени их окисления 2) больше степени их окисления 3) противоположна по знаку степени их окисления 4) меньше степени их окисления
2. В молекулах О2, N2, Сl2, Н2 связь …. 1) ионная 2) ковалентная полярная 3) ковалентная неполярная 4) водородная
3. Наибольшей способностью образовывать соединения с ионной связью обладают атомы …. 1) Сu и Сl 2) Н и Сl 3) Li и Сl 4) С и Сl
4. В ряду NаСl – МgСl2 – АlСl3 – SiСl4 – РСl5 степень ионности связи …. 1) увеличивается 2) уменьшается 3) не изменяется 4) вначале уменьшается, а затем увеличивается
5. Ковалентную неполярную связь имеет …. 1) хлорид натрия 2) молекула хлора 3) молекула хлороводорода 4) хлорид аммония
6. Ионный тип связи имеет …. 1) лёд 2) поваренная соль 3) алмаз 4) песок
7. В молекулах НСl, NН3, Н2Sе связи …. 1) водородные 2) ковалентные полярные 3) ковалентные неполярные 4) ионные
8. Ионную связь образуют атомы …. 1) различных неметаллов 2) типичных металлов и типичных неметаллов 3) различных металлов 4) одинаковых неметаллов
9. Образование ионной кристаллической решётки характерно для …. 1) иодида цезия 2) графита 3) иода 4) льда
10. Веществом, имеющим молекулярную кристаллическую решётку, является …. 1) СаО 2) СаН2 3) КСl 4) NН3
11. Степень ионности связи в ряду NiСl2 – СаСl2 – КСl – RbСl …. 1) увеличивается 2) уменьшается 3) не изменяется 4) сначала увеличивается, а затем уменьшается
12. Полярность ковалентной связи уменьшается в ряду …. 1) НF – Н2О – NН3 2) Н2О – Н2Sе – Н2S 3) НСl – НI – НВr 4) NН3 – NСl3 – NF3
13. Полярность ковалентной связи в ряду НСl – НВr – НI …. 1) увеличивается 2) не изменяется 3) уменьшается 4) вначале уменьшается, а затем увеличивается
14. Степень ионности связи в ряду АlСl3 – SiСl4 – РСl5 …. 1) уменьшается 2) увеличивается 3) не изменяется 4) сначала увеличивается, а затем уменьшается
15. Число σ-связей одинаково в молекулах …. 1) С2Н4 и РСl5 2) SО2 и С2Н2 3) SО2Сl2 и СОСl2 4) Н2SО4 и РОСl3
16. Число σ-связей одинаково в молекулах …. 1) С2Н4 и РСl5 2) SО2 и С2Н2 3) SО2Сl2 и СОСl2 4) Н2SО4 и РОСl3 17. Число π-связей одинаково в молекулах …. 1) С2Н4 и СО2 2) SО3 и Н2SО4 3) N2 и С2Н4 4) СО2 и С2Н2
18. Число двойных связей одинаково в молекулах …. 1) СО2 и SО3 2) Н2SО4 и НСlО4 3) SО2 и Н2SО4 4) N2 и С2Н2
19. В молекуле азота имеются …. 1) только σ-связи 2) только π-связи 3) одна σ- и две π-связи 4) одна π- и две σ-связи
20. Ковалентная связь по донорно-акцепторному механизму образуется в …. 1) NаF 2) НF 3) (НF)2 4) НВF4
21. При образовании π-связей в молекуле азота перекрываются электронные облака типа …. 1) s и s 2) s и р 3) р и р 4) р и d
22. При образовании ковалентной связи в молекуле водорода перекрываются электронные облака типа …. 1) s и s 2) s и р 3) р и р 4) р и d
23. Длина ковалентной связи наименьшая в молекуле …. 1) Сl2 2) SО2 3) NН3 4) Н2S
24. Длина ковалентной связи увеличивается в ряду …. 1) F2 – О2 – N2 2) НВr – НСl – НF 3) НF – Н2О – NН3 4) Н2S – Н2О – NН3
25. Прочность ковалентной связи в ряду Н2Sе – Н2S – Н2О …. 1) уменьшается 2) увеличивается 3) не изменяется 4) сначала увеличивается, а затем уменьшается 26. Химические формулы веществ, содержащих только ковалентные полярные связи, приведены в ряду …. 1) Н3РО4, ВF3, СН3СООNа 2) NО2, SОСl2, СН3СООН 3) РF5, Сl2О7, NН4Сl 4) F2, Н2SО4, Р2О5
27. Водородная связь образуется между молекулами …. 1) водорода 2) фтороводорода 3) теллуроводорода 4) гидрида мышьяка
28. Орбитали атома бериллия в молекуле ВеСl2 (газообразный хлорид бериллия) гибридизованы по типу …. 1) sр 2) sр2 3) sр3 4) d2sр3
29. Валентные углы в молекуле ВF3 равны …. 1) 600 2) 900 3) 109028' 4) 1200
30. Молекула ВСl3 имеет … строение. 1) угловое 2) тригональное 3) пирамидальное 4) тетраэдрическое
31. Молекула SnСl4 имеет … строение. 1) угловое 2) линейное 3) тетраэдрическое 4) пирамидальное
32. Молекула SnСl2 имеет … строение. 1) угловое 2) линейное 3) тетраэдрическое 4) пирамидальное
33. Молекула углекислого газа имеет … строение. 1) угловое 2) линейное 3) тетраэдрическое 4) плоское треугольное
34. Ковалентные полярные связи имеются в полярной молекуле …. 1) Н2О 2) СО2 3) АlСl3 4) ССl4
35. Ковалентные полярные связи имеются в неполярной молекуле …. 1) SО2 2) NН3 3) ССl4 4) Н2S
ОСНОВЫ ТЕРМОДИНАМИКИ ХИМИЧЕСКАЯ КИНЕТИКА
1. Гомогенной является реакция …. 1) СаСО3 (т) + 2НСl (р-р) = СаСl2 (р-р) + Н2О (ж) + СО2 (г) 2) 2SО2 (г) + О2 (г) = 2SО3 (г) 3) S (т) + О2 (г) = SО2 (г) 4) С (т) + СО2 (г) = 2СО (г)
2. Гетерогенной является реакция …. 1) Zn (к) + Н2О (г) = ZnО (к) + Н2 (г) 2) Н2 (г) + I2 (г) = 2НI (г) 3) 4НСl (г) + О2 (г) = 2Сl2 (г) + 2Н2О (г) 4) 2Н2О (г) = 2Н2 (г) + О2 (г)
3. Увеличение скорости химической реакции при повышении температуры обусловлено увеличением …. 1) энергии активации молекул 2) числа активных молекул 3) общего числа молекул 4) объёма системы
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 245; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.20.205 (0.013 с.) |

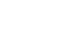
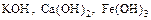 4)
4) 
 2) Р4О10 3)
2) Р4О10 3) 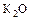 4)
4) 
 2)
2) 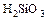 3) NаОН 4)
3) NаОН 4) 
 2)
2)  3)
3)  4) NО
4) NО 3)
3)  4)
4) 



 2)
2)  3)
3)  4)
4) 

 2)
2)  3)
3) 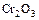 4)
4) 
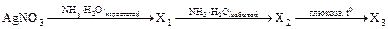
 2) Ag 3) AgCl 4) [Ag(NН3)2]NО3
2) Ag 3) AgCl 4) [Ag(NН3)2]NО3
 2) CuO 3)
2) CuO 3) 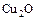 4) СuОН
4) СuОН
 2) Рb 3)
2) Рb 3)  4) РbО
4) РbО

 2)
2)  3) HCl 4)
3) HCl 4) 

 2)
2) 


 3)
3)  4)
4) 
 2)
2)  3)
3)  4)
4) 
 ,
,


 2)
2) 
 4)
4) 


 3)
3)  4)
4) 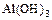
 2) 3 3) 31 4)
2) 3 3) 31 4) 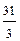
 3)
3)  4) 107 · 3
4) 107 · 3


 4) nэк (А) =
4) nэк (А) = 
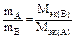 4) nэк (А) =
4) nэк (А) = 
 2) 1
2) 1  2) 1 3) 1
2) 1 3) 1  , D и T соответственно равно ….
, D и T соответственно равно …. равно ….
равно …. равно ….
равно ….


