
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие закономерности химических процессовСодержание книги
Поиск на нашем сайте
ХИМИЧЕСКАЯ КИНЕТИКА
1. Гомогенной является реакция …. 1) СаСО3 (т) + 2НСl (р-р) = СаСl2 (р-р) + Н2О (ж) + СО2 (г) 2) 2SО2 (г) + О2 (г) = 2SО3 (г) 3) S (т) + О2 (г) = SО2 (г) 4) С (т) + СО2 (г) = 2СО (г)
2. Гетерогенной является реакция …. 1) Zn (к) + Н2О (г) = ZnО (к) + Н2 (г) 2) Н2 (г) + I2 (г) = 2НI (г) 3) 4НСl (г) + О2 (г) = 2Сl2 (г) + 2Н2О (г) 4) 2Н2О (г) = 2Н2 (г) + О2 (г)
3. Увеличение скорости химической реакции при повышении температуры обусловлено увеличением …. 1) энергии активации молекул 2) числа активных молекул 3) общего числа молекул 4) объёма системы
4. При увеличении концентрации вещества А в 2 раза и уменьшении концентрации вещества В в 2 раза скорость реакции 2А + В = 2АВ …. 1) возрастёт в 2 раза 2) возрастёт в 4 раза 3) уменьшится в 2 раза 4) не изменится
5. На каталитический характер реакции указывает увеличение интенсивности …. 1) горения угля при его измельчения 2) горения фосфора при внесении его в атмосферу кислорода 3) разложения пероксида водорода в присутствии оксида марганца(IV) 4) окисление серы при подаче кислорода
6. Скорость гетерогенной реакции
А (г) + В (т) = АВ (г)
определяется уравнением …. 1) 3)
7. Для увеличения скорости гомогенной реакции 2NО + О2 = 2NО2 в 1000 раз давление необходимо увеличить в … раз(а). 1) 2 2) 5 3) 10 4) 20
8. Константа скорости химической реакции – это …. 1) скорость движения реагирующих веществ в газообразном состоянии 2) число соударений реагирующих частиц 3) скорость реакции при равных концентрациях реагирующих веществ 4) скорость реакции при единичных концентрациях реагирующих веществ
9. К изменению константы скорости химической реакции может привести изменение …. 1) давления или объёма системы 2) температуры системы 3) концентрации исходных веществ 4) концентрации продуктов реакции
10. Если при неизменной температуре концентрацию водорода в системе N2 (г) + 3Н2 (г) увеличить в 3 раза, то скорость прямой реакции …. 1) увеличится в 3 раза 2) уменьшится в 3 раза 3) увеличится в 27 раз 4) увеличится в 9 раз
11. Если при неизменной температуре давление в системе
FеО(т) + СО(г) увеличить в 2 раза, то скорость прямой реакции …. 1) увеличится в 2 раза 2) уменьшится в 2 раза 3) увеличится в 4 раза 4) увеличится в 6 раз
12. Если при неизменной температуре давление в системе
СО (г) + Н2 (г) уменьшить в 4 раза, то скорость обратной реакции …. 1) не изменится 2) увеличится в 4 раза 3) уменьшится в 4 раза 4) уменьшится в 16 раз
13. Для увеличения скорости реакции 2СО (г) в 4 раза концентрацию оксида углерода(II) необходимо увеличить в … раза. 1) 1,5 2) 2 3) 2,5 4) 3
14. Температурный коэффициент скорости большинства химических реакций принимает значения в пределах …. 1) 1 – 4 2) 2 – 4 3) 2 – 6 4) 1 – 6
15. Если температурный коэффициент скорости химической реакции равен 3, то ее скорость при повышении температуры на 20 0С …. 1) увеличится в 3 раза 2) увеличится в 9 раз 3) уменьшится в 3 раза 4) увеличится в 6 раз
ХИМИЧЕСКОЕ РАВНОВЕСИЕ
1. Константа равновесия обратимой химической реакции изменяется при …. 1) изменении давления 2) изменении температуры 3) введении катализатора 4) изменении концентрации реагирующих веществ
2. Химическое равновесие смещается влево при понижении температуры в системе …. 1) С (т) + Н2О (г) 2) Н2 (г) + Сl2 (г) 3) РСl5 (г) 4) СО (г) + Сl2 (г)
3. Понижение температуры вызывает смещение химического равновесия вправо в системе …. 1) СО (г) + Н2О (г) 2) С (т) + СО2 (г) 3) 4НСl (г) + О2 (г) 4) Н2 (г) + I2 (г)
4. Повышение давления практически не влияет на химическое равновесие в системе …. 1) 2SО2 (г) + О2 (г) 2) N2 (г) + 3Н2 (г) 3) FеО (т) + СО (г) 4) 3NО2 (г) + Н2О (ж)
5. Химическое равновесие смещается вправо при повышении давления в системе …. 1) 2NО (г) + О2 (г) 2) 2Н2О (г) 3) N2О4 (г) 4) СаСО3 (т) 6. Для подавления окисления оксида углерода (II) по реакции
2СО (г) + О2 (г)
необходимо …. 1) уменьшить температуру 2) увеличить давление 3) уменьшить давление 4) ввести катализатор
7. Фактором, способствующим термическому разложению известняка по реакции
СаСО3 (т)
является …. 1) повышение температуры 2) повышение давления 3) введение катализатора 4) увеличение концентрации оксида углерода(IV)
8. Смещение химического равновесия в системе
Н2 (г) + Сl2 (г)
влево вызывает …. 1) повышение температуры 2) понижение температуры 3) добавление катализатора 4) увеличение давления
9. Повышение выхода оксида углерода(II) по реакции
СО2 (г) + Н2 (г)
вызывает …. 1) увеличение давления 2) уменьшение давления 3) увеличение концентрации водорода 4) увеличение концентрации оксида углерода(IV)
10. Подавление разложения оксида марганца (IV) следует при …
4МnО2 (т)
1) повышении температуры 2) повышении давления 3) понижении давления 4) введении катализатора 11. Для подавления прямой реакции
СаСО3 (т)
необходимо …. 1) понизить температуру 2) понизить давление 3) повысить температуру 4) ввести катализатор 12. Для смещения химического равновесия в системе
SО2 (г) + Сl2 (г)
влево необходимо …. 1) понизить температуру 2) понизить давление 3) ввести катализатор 4) повысить концентрацию оксида серы (IV) 13. Для увеличения выхода продуктов реакции
2Рb(NО3)2 (т)
необходимо …. 1) понизить температуру 2) уменьшить давление 3) увеличить давление 4) увеличить температуру 14. Для повышения эффективности синтеза аммиака по реакции
N2 (г) + 3Н2 (г)
необходимо …. 1) повысить температуру 2) повысить давление 3) понизить концентрацию азота 4) повысить концентрацию аммиака
15. Для эффективного окисления азота по реакции
N2 (г) + О2 (г)
необходимо …. 1) повысить температуру 2) повысить давление 3) понизить температуру 4) понизить давление
|
||||
|
Последнее изменение этой страницы: 2016-12-27; просмотров: 273; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.17.3 (0.007 с.) |

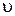 = k · сА 2)
= k · сА 2)  2NН3 (г)
2NН3 (г)


