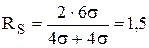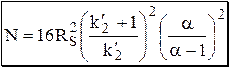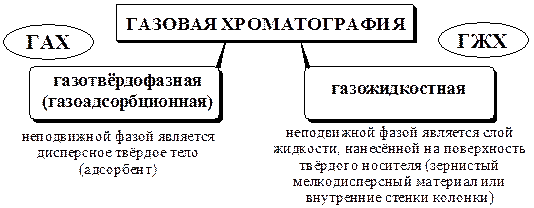Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Теории хроматографического разделенияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
При хроматографировании происходят два процесса: разделение веществ и размывание хроматографических зон разделяемых веществ. Хроматографический процесс заключается в многократном повторении актов сорбции и десорбции. Поскольку скорость сорбции и десорбции для молекул различных веществ различна, то после повторения большого числа элементарных актов хроматографического разделения при прохождении смеси веществ через слой сорбента происходит разделение её на отдельные компоненты. Положение и вид хроматографических зон разделяемых веществ зависят от формы изотермы сорбции, скорости установления равновесия, степени диффузии вещества в подвижной фазе. Изотермой сорбции называется зависимость концентрации вещества, сорбированного неподвижной фазой, от его концентрации в подвижной фазе при постоянной температуре. Если изотерма сорбции линейна, установление равновесия происходит мгновенно и степень диффузии вещества в подвижной фазе пренебрежимо мала, идеальный хроматографический пик описывается кривой нормального распределения. Для объяснения причин размывания хроматографических зон используются две теории: теоретических тарелок и кинетическая теория. Теория теоретических тарелок предполагает, что: · каждая хроматографическая колонка состоит из некоторого количества одинаковых по величине абстрактных узких слоёв, называемых теоретическими тарелками, на каждой тарелке происходит один элементарный акт сорбции-десорбции; · на каждой тарелке происходит мгновенное установление равновесия между веществом, находящимся в подвижной и неподвижной фазе; · переход вещества с одной тарелки на другую происходит дискретно - при попадании на тарелку новой порции элюента равновесие нарушается, и часть вещества мгновенно переносится на следующую тарелку, где вновь мгновенно наступает равновесие и т.д.; · на любой тарелке в любой момент времени число сорбируемых частиц вещества значительно больше числа сорбируемых частиц растворителя, изотерма сорбции является линейной. Количественной характеристикой хроматографической колонки являются: высота эквивалентная теоретической тарелке (H) и число теоретических тарелок (N).
Высота эквивалентная теоретической тарелке представляет собой дисперсию, приходящуюся на единицу длины колонки. Чем меньше H и больше N, тем в меньшей степени происходит размывание пика и тем эффективнее хроматографическое разделение (рис. 22.4).
Рис. 22.4. Хроматограммы вещества X, полученные на колонках с различной эффективностью ( размерность оси абсцисс одинакова) Число теоретических тарелок можно рассчитать:
где tR - время удерживания, kx - коэффициент, величина которого зависит того, на каком уровне измеряется ширина пика wx. Если пик представляет собой кривую нормального распределения, то ширина пика у основания равна 4s, на половине высоты - 2,35s, на 60,7% высоты (между точками перегиба) - 2s (рис. 22.5) и т.д. При измерении ширины пика у основания коэффициент kx будет равен 16 (42), на половине высоты - 5,54 (2,352) и т.д.
Рис. 22.5. Свойства идеального хроматографического пика Число теоретических тарелок является мерой эффективности колонки и обычно постоянно для всех пиков на хроматограмме. Так как N является постоянной величиной, то при увеличении времени удерживания ширина пика увеличивается. Согласно кинетической теории хроматографии размывание хроматографических пиков обусловлено одновременным действием трёх независимых друг от друга процессов:
Суммарное влияние вихревой диффузии, продольной диффузии и сопротивления массопереносу на величину высоты эквивалентной теоретической тарелке описывается уравнением Ван-Деемтера.
где U - линейная скорость подвижной фазы
Рис. 22.6. Зависимость H от линейной скорости газа-носителя Зависимость H от U для газовой хроматографии (насадочная колонка) показана на рис. 22.6. Оптимальную скорость газа-носителя, при которой величина Н минимальна, можно рассчитать по формуле:
В жидкостной хроматографии величина B практически не вносит вклад в размывание хроматографического пика (вязкость жидкости значительно больше вязкости газа), поэтому зависимость Н от U выглядит по-другому (как?). Для характеристики эффективности разделения компонентов смеси, используют коэффициент разделения (a) и разрешение (RS). Коэффициент разделения равен отношению исправленных времён удерживания (а также
Если a = 1, то разделение невозможно. Разрешение рассчитывается по следующей формуле:
Разделение двух пиков считается полным, если RS ³ 1,5 (при RS = 1,5 расстояние между максимумами пиков составляет 6s, степень перекрывания пиков 0,13%) - рис. 22.6.
Рис. 22.6. Перекрывание пиков при различной величине RS Число теоретических тарелок, необходимое для разделения с заданным разрешением, равно:
ГЛАВА 23
Общая характеристика Газовая хроматография - группа хроматографических методов, в которых подвижная фаза газообразна (находится в состоянии газа или пара). В зависимости от агрегатного состояния неподвижной фазы:
|
||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.72.24 (0.008 с.) |

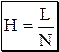
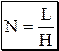

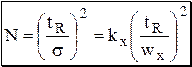

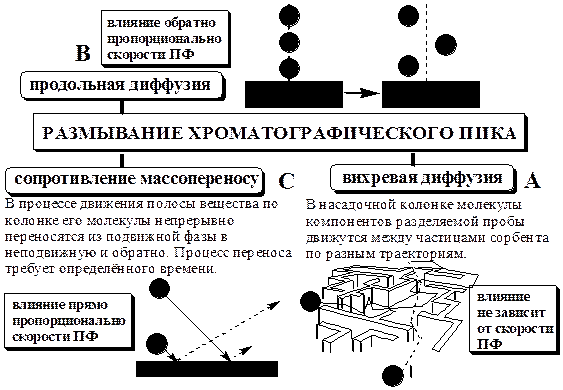


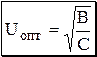
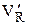 ,
, 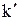 , D) веществ:
, D) веществ: