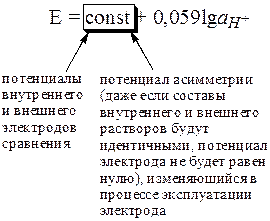Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Условия измерения аналитического сигналаСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Измерение ЭДС гальванического элемента проводят в условиях, которые близки к термодинамическим: · сила тока, протекающего через ячейку, должна быть равна 0; · время, в течение которого проводится измерение, должно быть достаточным для достижения равновесия. При измерении ЭДС в таких условиях можно считать, что величина соотношения
Приборы, позволяющие определять величину рХ (отрицательного логарифма активности иона Х в растворе), в комплекте с соответствующими ионоселективными электродами, называются иономерами. Если прибор предназначен для измерения активности только катионов водорода, то его называют рН-метром. Индикаторные электроды
Металлические электроды могут быть
Ионоселективные электроды (согласно IUPAC) – это сенсоры (чувствительные элементы, датчики), потенциалы которых линейно зависят от lg активности определяемого иона в растворе. В состав большинства ионоселективных электродов входит полупроницаемая мембрана, представляющая собой тонкую плёнку, отделяющую внутренний раствор (стандартный) от внешнего (анализируемого) и способную пропускать преимущественно ионы только одного вида (рис. 26.1)
Рис. 26.1. Принцип работы мембранного электрода К основным характеристикам ионоселективного электрода относят
Согласно рекомендациям IUPAC различают следующие виды ионоселективных электродов:
Стеклянный электрод для измерения рН (рис.26.2) имеет тонкую рН-чувствительную мембрану, изготовленную из специального стекла, содержащего 22% Na2O, 6% CaO и 72% SiO2. Внутри электрода находится 0,1 М HCl, насыщенный хлоридом серебра, и хлоридсеребряный электрод сравнения. Перед началом работы электрод, который хранился в сухом виде, вымачивают в 0,1 М HCl. Для того чтобы электрод работал, на внутренней и внешней сторонах мембраны должна образоваться тонкая плёнка гидратированного геля. Ионы водорода должны вытеснить ионы Na+ из пустот на поверхности стекла. В основе работы стеклянного электрода для измерения рН лежит ионообменное равновесие H+раствор › H+стекло
Из-за наличия потенциала асимметрии перед началом работы стеклянный электрод для измерения рН градуируют по стандартным буферным растворам (табл. 26.1). Табл. 26.1. Стандартные буферные растворы, используемые для градуировки стеклянного электрода
Стеклянный электрод может быть использован для измерения рН в ограниченном диапазоне рН, зависящем от сорта стекла, из которого изготовлена мембрана.
Прямая потенциометрия В прямой потенциометрии концентрацию (активность) определяемого вещества рассчитывают, исходя из величины ЭДС гальванического элемента. Чаще всего индикаторным в прямой потенциометрии является ионоселективный электрод. Прямые потенциометрические измерения, в которых используется ионоселективный электрод, называются ионометрией. Данный метод анализа характеризуется простотой и экспрессностью методик, недорогой аппаратурой
26.1.5. Потенциометрическое титрование Потенциометрическим титрованием называется метод анализа, основанный на регистрации изменения потенциала индикаторного электрода в процессе химической реакции между определяемым веществом и титрантом. В основе потенциометрического титрования могут лежать различные протолитические, окислительно-восстановительные, осадительные реакции и реакции комплексообразования, протекающие количественно, стехиометрично и с приемлемой скоростью. Выбор индикаторного электрода для выполнения потенциометрического титрования зависит от используемой реакции. Например, при кислотно-основном титровании обычно используют стеклянный рН-чувствительный электрод, при окислительно-восстановительном может быть использован инертный платиновый электрод, при комплексонометрическом – электрод, чувствительный по отношению к ионам определяемого металла и т.д. Конечную точку титрования обнаруживают с использованием кривой титрования, её производных, а также методом Грана. На рис. 26.3 показаны различные варианты обнаружения конечной точки титрования фосфорной кислоты гидроксидом натрия. Конечной точке титрования на исходной кривой титрования соответствует точка максимального наклона (точка перегиба) кривой, на её первой производной – точка максимума, второй производной – точка пересечения прямой, соединяющей две ветви кривой, с осью абсцисс. При использовании метода Грана конечной точке титрования соответствует точка пересечения прямых.
Рис. 26.3. Кривая потенциометрического титрования фосфорной кислоты (1), её первая (2) и вторая (3) производные, а также обнаружение конечных точек титрования методом Грана (4). Преимущества потенциометрического титрования перед титрованием с визуальным обнаружением конечной точки титрования заключаются в том, что: · отсутствует субъективная ошибка обнаружения конечной точки титрования · определение веществ может проводиться в окрашенных и мутных растворах; · имеется возможность дифференцированного титрования компонентов смеси (в особенности, при использовании неводного титрования); · возможна автоматизации процесса титрования.
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 465; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.119.117.77 (0.013 с.) |

 у поверхности электрода равна величине этого соотношения в растворе
у поверхности электрода равна величине этого соотношения в растворе
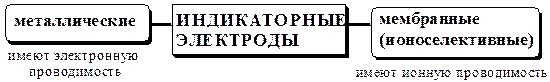




 Рис. 26.2. Стеклянный электрод
1 – внутренний хлоридсеребряный электрод; 2 – серебряная проволочка; 3 – 0,1 М HCl, насыщенный AgCl; 4 – стеклянная рН-чувствительная мембрана)
Рис. 26.2. Стеклянный электрод
1 – внутренний хлоридсеребряный электрод; 2 – серебряная проволочка; 3 – 0,1 М HCl, насыщенный AgCl; 4 – стеклянная рН-чувствительная мембрана)