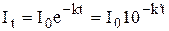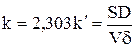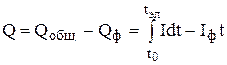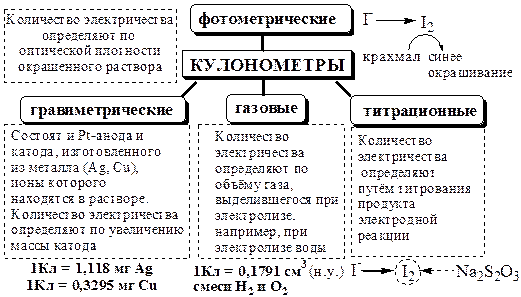Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кулонометрический метод анализаСодержание книги
Поиск на нашем сайте
Кулонометрическими называют электрохимические методы анализа, основанные на измерении количества электричества, прошедшего через электролитическую ячейку при электрохимическом окислении или восстановлении вещества на рабочем электроде. Общая характеристика и классификация Кулонометрия – это безэталонный метод анализа. Массу определяемого вещества при кулонометрических определениях рассчитывают непосредственно из величины аналитического сигнала. В основе кулонометрии лежат законы Фарадея для электролиза. Математическое выражение объединённого закона Фарадея имеет вид
где m – масса вещества, окисленного (восстановленного) в процессе электролиза; M – молярная масса вещества; n – число электронов, участвующих в электродной реакции; F – постоянная Фарадея (F = 96487 Кл/моль» 9,65×104 Кл/моль), Q – количество электричества, Кл. При проведении кулонометрических определений необходимо, чтобы: · отсутствовали побочные химические и электрохимические процессы, и выход по току был равен 100%; · определяемый элемент окислялся (восстанавливался) только до одной точно известной степени окисления; · был известен способ определения количества электричества или момента завершения реакции.
Прямая кулонометрия Прямые кулонометрические определения обычно проводят при постоянном потенциале. Прямая кулонометрия при постоянной силе тока используется в тех случаях, когда определяемое вещество находится на поверхности электрода или предварительно выделено на этой поверхности. Принципиальная схема установки для потенциостатических кулонометрических определений показана на рис. 26.4.
Рис. 26.4. Принципиальная схема установки для потенциостатических кулонометрических определений 1) рабочий электрод; 2) электрод сравнения; 3) вспомогательный электрод
Если на рабочем электроде протекает электрохимическая реакция первого порядка, то сила тока с течением времени уменьшается по экспоненциальному закону (рис. 26.5):
где S – площадь поверхности электрода, D – коэффициент диффузии электроактивного вещества; V – объём раствора в ячейке; d - толщина диффузионного слоя.
Для того чтобы электрохимическая реакция прошла до конца, теоретически требуется бесконечно большое время. Практически при проведении электролиза всегда остаётся некоторый фоновый ток (Iф), обусловленный превращением примесей, поэтому обычно электролиз считают законченным, когда сила тока станет равной 0,01 – 0,001 от первоначального значения. Для ускорения процесса электролиза необходимо создать такие условия, чтобы величина k в зависимости I от t была как можно большей. Для этого используют рабочий электрод с большой площадью поверхности, берут малый объём раствора и, кроме того, раствор в ячейке постоянно перемешивают (это приводит к уменьшению d). Количество электричества, затраченное на электрохимическое превращение вещества, в потенциостатической кулонометрии равно:
Для определения количества электричества, прошедшего через электролитическую ячейку, используют следующие приёмы:
Кулонометром называется электролитическая ячейка, подключаемая последовательно с кулонометрической ячейкой, в которой при замыкании электрической цепи со 100% выходом по току протекает электрохимическая реакция известной стехиометрии.
Прямая кулонометрия используется для определения соединений Cu, Au, Ag, Tl, Sb и других элементов, а также для хинонов и гидрохинонов, многоатомных фенолов, нитро-, нитрозо- и азо-соединений, галогенопроизводных и т.д.
|
||||||
|
Последнее изменение этой страницы: 2016-12-13; просмотров: 1122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.27.43 (0.009 с.) |

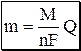
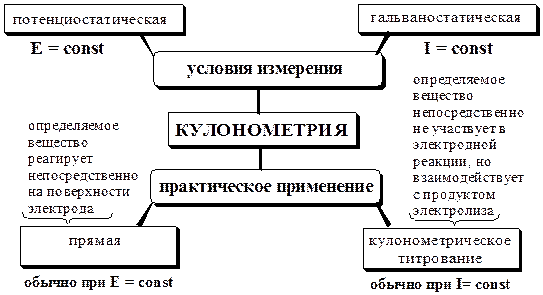

 Рис. 26.5. Зависимость I от t в потенциостатической кулонометрии
Рис. 26.5. Зависимость I от t в потенциостатической кулонометрии