
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изменение равновесного состоянияСодержание книги
Поиск на нашем сайте
Равновесное состояние может быть целенаправленно изменено варьированием температуры (1) и состава реакционной смеси (2). (1) Для количественного осаждения свинца в виде PbI2 реакцию: Pb2+ + 2I− ↔ PbI2↓ проводят при пониженной температуре, так как этот процесс экзотермический (ΔH < 0): уменьшение Т смещает равновесие вправо. (2) Рассмотрим реакцию: H2O + CO ↔ H2 + CO2. При температуре ~ 850о C константа равновесия ее равна единице:
Пусть смешали по 2 моля H2O и CO. В равновесной смеси появятся H2 и CO2 по x моль, на столько же (по уравнению) уменьшится количество H2O и CO: Вещества H2O CO H2 CO2 Исходный состав (моль) 2 2 0 0 Равновесный состав (моль) 2- x 2- x x x. Решив уравнение:
относительно x, получим состав равновесной смеси: по 1 молю всех участников (x =1). Если теперь увеличить количество H2O на 1 моль, то новое равновесное состояние будет отличаться от предыдущего тем, что количество H2 и CO2 возрастет до 1,2 моль, а CO уменьшится до 0,8. Вещества H2O CO H2 CO2 Равновесный состав (моль) 1 1 1 1 Исходный состав (моль) 2 1 1 1 Равновесный состав (моль) 2- x 1- x 1+ x 1+ x. Решив уравнение:
относительно x, получим состав: Вещества H2O CO H2 CO2 Равновесный состав (моль) 1,8 0,8 1,2 1,2. Следовательно, при добавлении воды степень превращения CO и выход продуктов увеличился – равновесие сместилось вправо. Того же результата можно достичь, если уменьшить количество любого продукта реакции. Очевидно, что обратные действия приведут к смещению равновесия влево. Для смещения равновесия в прямом направлении необходимо использовать избыток исходных веществ и удалить продукты из зоны реакции (осаждением, выпариванием, дистилляцией, экстракцией, сорбцией). Для подавления реакции обычно в реакционную смесь добавляют продукты. Равновесия в растворах электролитов Проводниками будем называть вещества (материалы, смеси и т.д.), способные проводить электрический ток. В зависимости от природы частиц, переносящих электрический заряд, проводники можно разделить на электронные, ионные и со смешанной проводимостью (без учета дырочной), что показано на схеме 2 с некоторыми примерами. В дальнейшем будем рассматривать лишь водные растворы кислот, оснований и солей. Теория Аррениуса Объяснение некоторых особенностей свойств растворов электролитов от неэлектролитов было дано Аррениусом. Оно касалось в первую очередь коллигативных свойств: понижения давления пара над раствором компонента по сравнению с давлением над чистыми веществами; повышения температуры кипения и понижения температуры замерзания раствора по сравнению с растворителем; осмотическое давление. Положения теории Аррениуса (теории для слабых электролитов) следующие: 1. При растворении в воде молекулы веществ распадаются (диссоциируют, ионизируют) на заряженные частицы: положительные катионы (С) и отрицательные анионы (A):
где n и m – число катионов и анионов соответственно; m+ и n– ‑ их зарядовые числа (“заряды”). Ионизация не связана с прохождением электрического тока через раствор.
2. Диссоциируют не все молекулы; часть их остается нераспавшимися. Степень диссоциации (ионизации) αi характеризует долю (или процент) распавшихся молекул:
где νi – равновесное число молекул (молей) i-го вещества “после” ионизации. 3. Между нераспавшимися молекулами и ионами устанавливается динамическое ческое равновесие, которое можно описывать, как химическое равновесие, константой равновесия, называемой константой электролитической диссоциации (ионизации). Выражение для концентрационной константы ионизации:
Степень ионизации, константа ионизации Степень ионизации αi изменяется от 0 (для неэлектролитов) до 1 0 Это зависит от природы вещества, природы растворителя, концентрации и температуры. При умеренных концентрациях (~ 0,1÷1,0 М) по значению αi все электролиты делят на сильные и слабые. Для водных растворов к сильным электролитам (αi близка к единице) относят: - сильные кислоты (HCl, HNO3, H2SO4), - сильные основания (NaOH, KOH), - большинство солей (NaCl, BaSO4, Cu(NO3)2, NaCH3COO). К слабым электролитам (αi много меньше единицы, ~ 0,01) относят: - слабые минеральные и органические кислоты (HCN, Н2СО3, H2S, CH3COOH, H2C2O4·2H2O), - слабые минеральные и органические основания (NH3·H2O, CH3NH2·H2O, C6H5NH2·H2O), - некоторые соли (HgCl2, Hg(CN)2, Fe(SCN)3, CdI2). Закон разбавления Оствальда Рассмотрим ионизацию простейшего электролита, молекула которого состоит из одного катиона (С) и одного аниона (А). Пусть его степень ионизации αi, концентрация c: CA ↔ C+ + A–. При равновесии концентрации катионов и анионов равны с·αi, а недиссоциированных молекул с-с αi= с(1-αi), тогда выражение для константы ионизации Ki:
Если в знаменателе можно пренебречь αi по сравнению с единицей, то получим: Ki = с·αi2. Так как по определению Ki есть величина постоянная, не зависящая от концентрации, увеличение с приводит к уменьшению αi и наоборот. В предельно разбавленном растворе (с→0) степень ионизации стремится к единице. Понятия степень ионизации и константа ионизации применяются в основном к растворам слабых электролитов. Однако и для сильных электролитов αi как эффективная степень ионизации при концентрации с определяется в виде отношения: α с = где λс – эквивалентная электропроводимость раствора при концентрации с; λ0 − эквивалентная электропроводимость предельно разбавленного раствора, то есть при концентрации, стремящейся к нулю. Константа ионизации (диссоциации – менее предпочтительное, устаревающее название) зависит от природы растворенного вещества и растворителя, от температуры. По значению Ki можно судить о силе слабого электролита, например, сила кислот уменьшается в ряду муравьиная > уксусная > фенол симбатно с уменьшением Ki: HCOOH − 1,77·10-4; CH3COOH − 1,75·10-5; C6H5OH – 1,01·10-10. Многоосновные кислоты и основания ионизируют ступенчато, причем константа ионизации следующей ступени, как правило, меньше предыдущей, например, для лимонной кислоты: 1 ступень C6H8O7 ↔ H+ + C6H7O7−, K1 = 7,45·10-4, 2 ступень C6H7O7 ↔ H+ + C6H6O72−, K2 = 1,73·10-5, 3 ступень C6H6O7 ↔ H+ + C6H5O73−, K3 = 4,02·10-6. Общая константа ионизации равна произведению констант отдельных ступеней K = ∏Ki = K1·K2·K3·…. Ионное произведение воды Вода – слабый электролит. Ее ионизация Н2О ↔ ОН− + Н+ описывается константой
Концентрация непроионизировавших (непродиссоциировавших) молекул воды практически не меняется при смещении равновесия, поэтому как постоянную величину ее можно объединить в виде произведения с Ki в новую константу Kw, называемую ионное произведение воды
Kw не зависит от концентрации ионов ОН− или Н+. Их произведение при данной температуре есть величина постоянная, например, при 298 К Kw =1,008·10−14 (моль/л)2. Более удобно пользоваться величиной, полученной после логарифмирования, обозначив действие оператором pX=−lgX:
При равновесии [ОН−] = [Н+] = Процесс ионизации воды сопровождается поглощением энергии в форме теплоты (∆Hi>0), поэтому при увеличении температуры Kw возрастает. Например, при 100о С pKw =12,23, то есть почти в 100 раз больше, чем при 25о С. Гидролиз солей Чистая вода имеет нейтральную реакцию, так как при ее ионизации: HOH ↔ H+ + OH─ концентрации ионов H+ и OH– равны. Опыт показывает, что водные растворы средних солей имеют кислую, щелочную или нейтральную реакции, хотя их молекулы не содержат ни ионов Н+, ни ионов ОН–. Это объясняется обратимым взаимодействием ионов соли с молекулами воды, сопровождающимся нарушением равновесия ионизации воды (изменением рН раствора), которое называется гидролизом соли. При этом образуется слабый электролит. Гидролизу подвергаются соли, образованные при взаимодействии:
Рассмотрим первый случай. Ацетат натрия CH3COONa в воде полностью диссоциирует на ионы, т.к. является сильным электролитом. Ионное уравнение гидролиза: CH3COO–+ Na+ + HOH ↔ CH3COOH + Na+ + OH– показывает, что образуется уксусная кислота ‑ слабый электролит, то есть ионы H+ связываются ионами CH3COO–. Ионов OH– в р-ре становится больше, чем Н+ ‑ р-р имеет щелочную реакцию (pH>7). Говорят, что имеет место гидролиз по аниону. Во втором случае раствор NH4Cl имеет кислую реакцию (pH<7), т.к. ионы OH– связываются катионами NH4+ с образованием слабого электролита NH3·H2O. Это пример гидролиза по катиону, при котором концентрация Н+ становится больше, чем концентрация гидроксил ионов. В третьем случае происходит гидролиз и по катиону, и по аниону. Значение pH раствора зависит от соотношения сил слабой кислоты и слабого основания. Хлорид натрия NaCl не подвергается гидролизу, раствор имеет нейтральную реакцию (pH=7), ионы H+ и OH– не связываются, так как NaOH и HCl– сильные электролиты. Na+ + Cl– + HOH ↔ Na+ + OH– + H+ + Cl–. Ступенчатый гидролиз Ступенчатому гидролизу подвергаются соли, образованные многоосновными слабыми кислотами или многоосновными слабыми основаниями. Гидролиз по аниону (pH>7). Na2CO3 + HOH ↔NaHCO3+ NaOH – первая ступень, NaHCO3+ HOH ↔ H2CO3 + NaOH – вторая ступень. Гидролиз по катиону (pH<7). AlCl3 + HOH ↔ AlOHCl2 + HCl – первая ступень, АlOHCl2 +H2O ↔ Al(OH)2Cl + HCl – вторая ступень, Al(OH)2Cl + HOH ↔ Al(OH)3 + HCl – третья ступень (очень мало). Гидролиз – как правило, обратимый процесс не идущий до конца. Необратимый гидролиз – если продукты уходят из реакции (↓и↑). Al2S3 + 6H2O = 2Al(OH)3↓+3H2S↑ Обратной гидролизу является реакция нейтрализации CH3COO– + HOH ↔ CH3COOH+ OH–. Подавление и усиление гидролиза Для усиления гидролиза соли, гидролизующейся по катиону, необходимо добавить основание для связывали ионов Н+ Кt+ + HOH ↔ KtOH +H+ При добавлении кислоты в этом случае гидролиз подавляется. Принцип управления гидролизом соли, образованной слабой кислотой, аналогичен: An– + HOH ↔ AnH + OH–. Для усиления – добавляют кислоту, для уменьшения – основание. Катионы водорода можно связать в кислые анионы (HCO–3) или в нейтральные молекулы слабых кислот (H2CO3), действуя на растворы солями сильных оснований слабых кислот, например, Na2CO3.Анионы можно связывать в комплексные ионы, например, [Co(OH)]+, [Al(OH)2]+.
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 494; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.142.255.103 (0.007 с.) |

 .
.
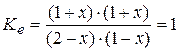
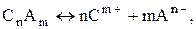


 ‑ число молекул (молей) i-го вещества “до” ионизации;
‑ число молекул (молей) i-го вещества “до” ионизации; .
. αi
αi  или
или  .
. ,
, .
. .
.
 = 10−7 моль/л, поэтому pOH = pH = 7 для нейтрального раствора. В кислом растворе [ОН−] < [Н+] и pH < 7 (например, pH = 3, pOH = 14–3 = 11). В щелочном растворе [ОН−] > [Н+] и pH > 7 (например, pH = 9, pOH = 14–9 = 5).
= 10−7 моль/л, поэтому pOH = pH = 7 для нейтрального раствора. В кислом растворе [ОН−] < [Н+] и pH < 7 (например, pH = 3, pOH = 14–3 = 11). В щелочном растворе [ОН−] > [Н+] и pH > 7 (например, pH = 9, pOH = 14–9 = 5).


