
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Электролиты и электролитическая диссоциацияСодержание книги
Поиск на нашем сайте Растворы, проводящие электрический ток, называются растворами электролитов. Существуют две основные причины прохождения электрического тока через проводники: либо за счет переноса электронов, либо за счет переноса ионов. Электронная проводимость присуща, прежде всего, металлам. Ионная проводимость присуща многим химическим соединениям, обладающим ионным строением, например, солям в твердом или расплавленном состояниях, а также многим водным и неводным растворам. Все вещества по их поведению в растворах принято делить на две категории: а) вещества, растворы которых обладают ионной проводимостью (электролиты); б) вещества, растворы которых не обладают ионной проводимостью (неэлектролиты). К электролитам относится большинство неорганических кислот, оснований и солей. К неэлектролитам относятся многие органические соединения, например, спирты и углеводы. Оказалось, что растворы электролитов обладают более низкими значениями температуры плавления и более высокими температурами кипения по сравнению с соответствующими значениями для чистого растворителя или для раствора неэлектролита в этом же растворителе. Для объяснения этих фактов Аррениус предложил теорию электролитической диссоциации. Под электролитической диссоциацией понимается распад молекул электролита в растворе с образованием положительно и отрицательно заряженных ионов – катионов и анионов. Например, молекула уксусной кислоты так диссоциирует в водном растворе: СН3СООН Процесс диссоциации во всех случаях является обратимым, поэтому при написании уравнений реакции диссоциации применяется знак обратимости Сильные и слабые электролиты. Степень диссоциации. Константа диссоциации. Степенью диссоциации α называют – отношение числа молекул, распавшихся на ионы (n) к общему числу растворенных молекул (n0). α = (n/n0) ∙ 100 Степень диссоциации может изменяться от 0 до 1, от отсутствия диссоциации до полной диссоциации. В зависимости от величины степени диссоциации различают слабые и сильные электролиты. К слабым электролитам относят вещества, у которых степень диссоциации в 0,1 М растворах меньше 3%; если степень диссоциации в 0,1 М растворе превышает 30%, то такой электролит называют сильным. Электролиты, степень диссоциации которых лежит в пределах от 3% до 30%, называются электролитами средней силы. К сильным электролитам относятся большинство солей, некоторые кислоты – НСl, НВr, НI, НNО3, НСlO4, Н2SO4 и основания щелочных и щелочноземельных металлов – щелочи LiОН, NаОН, КОН, RbОН, СsОН, Са(ОН)2, Sr(ОН)2, Ва(ОН)2. Уравнение реакции диссоциации электролита АК на катионы К+ и анионы А– можно в общем виде представить следующим образом: КА и степень диссоциации α в данном случае можно выразить отношением молярной концентрации образовавшихся ионов [К+] или [А–] к первоначальной молярной концентрации электролита [АК]о, т.е.
С увеличением концентрации раствора степень диссоциации электролита уменьшается. Многоосновные кислоты и основания диссоциируют ступенчато – вначале от молекулы отщепляется один из ионов, затем другой и т.д. Каждая ступень диссоциации характеризуется своим значением константы диссоциации. I ступень: Н2SO4 → Н+ + НSO4– II ступень: НSO4– Общее уравнение: Н2SO4 Процесс электролитической диссоциации характеризуют константой диссоциации(К). Так, для реакции КА К = [К+] ∙ [ А–]/[КА] Между константой и степенью электролитической диссоциации существует количественная связь. В приведенном примере общую концентрацию растворенного вещества обозначим с, а степень диссоциации α. Тогда [К+] = [А–] = α∙с и соответственно концентрация недиссоциированных частиц [КА] = (1 – α) с. Подставив значения в выражение для константы диссоциации, получим соотношение
Данные уравнения является математическим выражением закона разведения Оствальда: константа диссоциации электролита не зависит от разведения раствора. Ионное произведение воды. рН раствора. Значение константы диссоциации воды КН2О = 1·10–14. Данную константу для воды называют ионным произведением воды, которое зависит только от температуры. Согласно реакции Н2О рН = –lg[Н+] Водные растворы имеют значение рН в интервале от 1 до 14. По соотношению концентраций этих ионов различают три типа сред: нейтральную, кислую и щелочную. Нейтральная среда – среда, в которой концентрации ионов [Н+] = [ОН–] = 10–7 моль/л (рН = 7). Кислая среда – среда, в которой концентрация ионов [Н+] больше концентрации ионов [ОН–], т.е. [Н+] > 10–7 моль/л (рН < 7). Щелочная среда –среда, в которой концентрация ионов [Н+] меньше концентрации ионов [ОН–], т.е. [Н+] < 10–7 моль/л (рН > 7). Качественно реакцию среды и рН водных растворов электролитов определяют при помощи индикаторов и рН-метра. Например, если концентрация ионов [H+] = 10–4 моль/л, то рН = – lg10–4 = 4 и среда раствора кислая, а если концентрация ионов [ОН–] = 10–4 моль/л, то [Н+] = К (Н2O) – [ОН–] = 10–14 – 10–4 = 10–10, а рН = – lg10–10 = 10 и среда раствора щелочная.
Произведение растворимости. Растворение твердого вещества в воде прекращается тогда, когда образуется насыщенный раствор, т.е. устанавливается равновесие между твердым веществом и частицами того же вещества, находящимися в растворе. Так, например, в насыщенном растворе хлорида серебра устанавливается равновесие: AgClтв В насыщенном растворе электролита произведение концентраций его ионов есть величина постоянная при данной температуре и эта величина количественно характеризует способность электролита растворяться, называется она произведением растворимости (ПР). ПР(АgCl) = [Аg+][Cl–] Произведение растворимости – это постоянная величина, равная произведению концентраций ионов малорастворимого электролита в его насыщенном растворе. В общем случае для малорастворимого электролита состава AmBn можно записать: AmBn ↔ mA + nB ПРAmBn = [A]m ∙ [B]n Зная величины произведений растворимости, можно решать вопросы, связанные с образованием или растворением осадков при химических реакциях, что особенно важно для аналитической химии. Гидролиз солей Взаимодействие солей с водой, в результате которого образуются кислота (или кислая соль), и основание (или основная соль), называется гидролизом солей. Правило направления протекания ионных реакций: реакции между ионами в растворах электролитов идут практически до конца в сторону образования осадков, газов и слабых электролитов. Гидролизу подвергаются соли образованные: - слабым основанием и сильной кислотой (например, MgCl2, CuSO4), и гидролиз идет по катиону, т.к. молекулы слабого электролита образуются за счет катионов; - слабой кислотой и сильным основанием (например, Na2CO3, K2S, CH3COONa), и гидролиз идет по аниону, т.к. молекулы слабого электролита образуются за счет анионов; - слабым основанием и слабой кислотой (например, NH4CN, CH3COONH4), и гидролиз идет по аниону и катиону, т.к. молекулы слабого электролита образуются за счет анионов и катионов. Соли, образованные сильным основанием и сильной кислотой (например, NaCl, Na2SO4, KNO3) гидролизу не подвергаются, т.к. в этом случае не образуются молекулы слабого электролита. Уравнения реакций гидролиза пишутся аналогично другим ионным уравнениям: малодиссициированные (в том числе вода) и малорастворимые, а также газообразные продукты гидролиз и исходные вещества пишутся в виде молекул, сильные электролиты записываются в ионной форме. Краткое ионное уравнение показывает какие ионы (Н+ или ОН–) накапливаются в растворе данной соли при растворении, что позволяет определить реакционную среду рассматриваемой соли. Так, если в кратком ионном уравнении имеются ионы Н+, то реакция среды раствора этой соли кислая, а гидролиз будет идти по катиону. Если в кратком ионном уравнении имеются ОН–, то реакция среды раствора этой соли щелочная, а гидролиз будет идти по аниону. Если же краткое ионное уравнение показывает, что в растворе присутствуют и ионы Н+ и ОН–, то реакция среды нейтральная, а гидролиз будет идти и по и аниону и по катиону. Пример. Составить уравнение гидролиза ацетата натрия СН3СООNа (соль сильного основания и слабой кислоты) и определить реакцию среды в растворе этой соли. – запишем уравнение реакции гидролиза в молекулярной форме: СН3СООNа + Н2О (образовался слабый электролит – уксусная кислота) – составим полное ионное уравнение данной реакции: СН3СОО– + Nа + + Н2О – составим краткое ионное уравнение данной реакции: СН3СОО– + Н2О Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы ОН– и реакция среды будет щелочной (рН > 7). Пример. Составить уравнение гидролиза хлорида железа (II) – соли слабого основания и сильной кислоты, определить реакцию среды в растворе этой соли. FеСl2 + Н2O Fе2+ + 2Сl – + Н2O Fе2+ + Н2O По второй ступени гидролиз протекает следующим образом: Fе(ОН)Сl + Н2O Fе(ОН)– + Сl – + Н2O Fе(ОН)– + Н2O Краткое ионное уравнение гидролиза показывает, что в растворе накапливаются ионы Н+ и реакция среды будет кислой (рН < 7). В общем случае: - если соль образована сильным основанием и слабой кислотой, то рН > 7; - если соль образована слабым основанием и сильной кислотой, то рН < 7; - если соль образована слабым основанием и слабой кислотой, то рН ≈ 7; - если соль образована сильным основанием и сильной кислотой, то рН = 7. Гидролиз солей, образованных слабым многоосновным основанием или слабой многоосновной кислотой, протекает ступенчато, число ступеней гидролиза равно заряду катиона слабой кислоты или слабого основания (если гидролиз идет и по катиону и по аниону, то число ступеней равно наибольшему из зарядов): - при гидролизе солей, образованных слабым многокислотным основанием и сильной кислотой, образуются основные соли (содержащие катион металла, анионы ОН– и кислотного остатка, например, FеОНСl2 – гидроксохлорид железа III); - при гидролизе солей, образованных слабой многоосновной кислотой и сильным основанием, образуются кислые соли (содержащие анионы кислотного остатка, катионы металла и Н+, например, КНСО3 – гидрокарбонат калия). Гидролиз по второй и, особенно, по третьей ступени выражен незначительно Пример. Составить уравнения гидролиза и определить реакцию среды в растворе хлорида железа (III). Реакция гидролиза FеСl3 проходит в три стадии, так как заряд иона железа равен 3+: 1) составим молекулярное, полное и краткое ионное уравнение первой ступени гидролиза: молекулярное уравнение: FеСl3 + НОН ↔ FеОНСl2 + НСl полное ионное уравнение: Fе3+ + 3Cl – + НОН ↔ (FеОН)2+ + 2Сl – + H+ + Сl – краткое ионное уравнение: Fе3+ + НОН ↔ (FеОН)2+ + H+ 2) составим молекулярное, полное и краткое ионное уравнение второй ступени гидролиза: FеОНСl2 +НОН ↔ Fе(ОН)2Сl + НСl FеОН2+ + 2Сl – + НОН ↔ (Fе(ОН)2)+ + Сl – + H+ + Сl – FеОН2+ + НОН ↔ (Fе(ОН)2)+ + H+ 3) составим молекулярное, полное и краткое ионное уравнение третьей ступени гидролиза: Fе(ОН)2Сl + НОН ↔ Fе(ОН)3↓ + НСl Fе(ОН)2+ + Сl – + НОН ↔ Fе(ОН)3↓ + H+ + Сl – Fе(ОН)2+ + НОН ↔ Fе(ОН)3↓ + H+ 4) общее уравнение реакции гидролиза в молекулярной полной и краткой ионной форме имеет вид: FеСl3 + НОН ↔ Fе(ОН)3↓ + 3НСl Fе3+ + 3Сl – + 3НОН ↔ Fе(ОН)3↓ + 3H+ + 3Сl – Fе3+ + 3НОН ↔ Fе(ОН)3↓ + 3H+ Таким образом, гидролиз соли, образованной слабым трехкислотным основанием и сильной кислотой идет по катиону в три стадии, а накопление ионов H+ приводит к тому, что рН < 7. Степень гидролиза (h) – соотношение числа молекул, подвергшихся гидролизу к общему числу молекул. В разбавленных растворах гидролиз можно охарактеризовать константой гидролиза (КГ). Так, для соли образованной сильным основанием и слабой кислотой: KCN + HOH → KOH + HCN CN– + HOH → OH– + HCN КГ = [OH–][HCN] / [CN–] ∙ [HOH] Концентрация недиссоциированных молекул воды постоянна, тогда КГ = [OH–] ∙ [HCN] / [CN–] Так как [H+][ОН–] = Кводы, то [ОН–] = Кводы / [H+], и преобразуя константу гидролиза получим: КГ = Кводы [ HCN] / [CN–] ∙ [H+], т.е. КГ = Кводы / Ккислоты Аналогично, константа гидролиза соли слабого основания и сильной кислоты выражается соотношением ионного произведения воды и константы диссоциации соответствующего основания: КГ = Кводы / Коснования
Глава 8. ДИСПЕРСНЫЕ СИСТЕМЫ Наука, изучающая свойства веществ в дисперсном состоянии и явления на поверхности раздела фаз – коллоидная химия. Дисперсные системы – гетерогенные двух- или многофазовые системы, состоящие из частиц дисперсной фазы и окружающей их дисперсионной среды.
|
||
|
Последнее изменение этой страницы: 2016-08-14; просмотров: 267; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.108 (0.011 с.) |

 СН3СОО– + Н+
СН3СОО– + Н+ К+ + А–
К+ + А–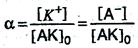
 Н+ + SO42–
Н+ + SO42– К+ + А– константа диссоциации:
К+ + А– константа диссоциации: , поскольку молярная концентрация равна C = 1/V, то
, поскольку молярная концентрация равна C = 1/V, то 
 Н+ + ОН–, при диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–] = 10–7.
Н+ + ОН–, при диссоциации воды на каждый ион Н+ образуется один ион ОН–, следовательно, в чистой воде концентрации этих ионов одинаковы: [Н+] = [ОН–] = 10–7. СН3СООН + NаОН
СН3СООН + NаОН Fе(ОН)Сl + НСl
Fе(ОН)Сl + НСl Fе(ОН)2↓ + Н+
Fе(ОН)2↓ + Н+


