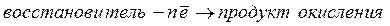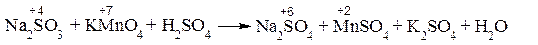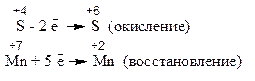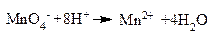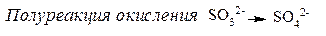Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 4. Определение константы и степени гидролиза солей измерением рН раствораСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Определите рН 0,1 М раствора NH4Cl при помощи рН-метра. 2. Затем разбавлением исходного раствора приготовьте 0,001 М раствор NH4Cl. Для этого пипеткой на 1 мл отмерить 1 мл 0,1 М раствора NH4Cl, внесите в колбу на 100 мл. Довести объем раствора в колбе до метки дистиллированной водой, закройте колбу пробкой и тщательно перемешайте раствор, переворачивая колбу несколько раз. Определить рН полученного раствора хлорида аммония. 3. Вычислите константы гидролиза соли NH4Cl(Кгидр) по найденным значениям рН, исходя из следующих соображений. В соответствии с уравнением гидролиза NH4Cl:
константа гидролиза этой соли равна:
Из уравнения гидролиза видно, что [NH4OH] = [H+]. Вследствие практически полной диссоциации солей в растворе при небольших значениях степени гидролиза равновесная концентрация NH4+-иона мало отличается от начальной, т.е. можно принять, что [NH4+]равн. = С соли. Тогда получаем расчетную формулу:
Ссоли в растворах известна, а концентрацию Н+-ионов вычислите для каждого случая по найденным экспериментально значениям рН. 4. Вычислите степень гидролиза NH4Cl во всех исследованных растворах. Степень гидролиза h связана с константой гидролиза следующим уравнением:
Сравните экспериментальные значения К гидр и h в растворах хлорида аммония с вычисленными. Сделать вывод о влиянии концентрации соли на константу гидролиза и степень гидролиза при неизменной температуре.
Контрольные вопросы и задания 1. Что такое гидролиз солей? Дайте определение. 2. Какие соли подвергаются гидролизу? Приведите примеры. 3. Как рассчитать константу гидролиза? 4. Какие факторы влияют на гидролиз солей и почему? 5. Как влияет нагревание раствора на протекание гидролиза? 6. Как влияет разбавление на протекание гидролиза? 7. Составьте молекулярные и ионные уравнения гидролиза следующих солей: NaCN, ZnBr2, Fe2(SO4)3, KNO2, K2SO3, СH3COONa, Pb(NO3)2, NH4Cl, Na2S, K3PO4, NH4NO3, K2CO3, CuCl2, KCN, NiSO4, (NH4)2SO4, FeCl3, Ba(NO2)2, AlBr3, Cr(NO3)3, Ca(CH3COO)2, Na3PO4, Ba(CN)2, Na2SO3, KCNS, Na2CO3, CuSO4, NiCl2, NaNO2, Fe(NO3)3, ZnSO4, LiNO2, CdCl2, Ca(CN)2, FeBr3, Cu(NO3)2, Ba(CH3COO)2, CoSO4, CrCl3, Ca(NO2)2, NH4Br, Al2(SO4)3, CrCl3, CH3COOK, AlCl3, NH4I, Cr2(SO4)3. В какой цвет будет окрашен универсальный индикатор в растворах этих солей? Лабораторная работа №6 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Цель работы Приобретение навыков составления уравнений окислительно-восстановительных реакций; ознакомление с особенностями протекания окислительно-восстановительных реакций и их классификацией.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Окислительно-восстановительная реакция(ОВР) −это единый процесс, состоящий из двух разных полуреакций: полуреакции окисления и полуреакции восстановления, которые идут одновременно. Окисление − это процесс потери электронов атомом, молекулой или ионом. Восстановление − это процесс присоединения электронов атомом, молекулой или ионом. Окислителем называется вещество, атомы, молекулы или ионы которого присоединяют электроны:
Окислитель восстанавливается в процессе восстановления. Восстановителем называется вещество, атомы, молекулы или ионы которого отдают электроны:
Восстановитель окисляется в процессе окисления. Число электронов, отданных восстановителем, равно числу электронов, принятых окислителем. При написании уравнений ОВР используют два метода расстановки коэффициентов: метод электронного баланса и метод полуреакций. Метод электронного баланса (окислительных чисел) рассмотрим на примере реакции
Для расстановки коэффициентов выполняем следующие действия. 1. Определяем элементы, атомы которых изменяют степень окисления:
2. Находим окислитель и восстановитель в данной ОВР и пишем отдельно электронные уравнения процессов окисления и восстановления:
3. Уравниваем число электронов в процессе окисления и восстановления (электронный баланс):
4. Коэффициенты 5 и 2 из электронных уравнений переносим в молекулярное уравнение ОВР:
5. Окончательно уравниваем число атомов каждого элемента в обеих частях молекулярного уравнения:
Mетод полуреакций (ионно-молекулярный метод) основан на составлении уравнений процессов окисления и восстановления с помощью ионов и молекул, реально существующих в растворе. Сильные электролиты записывают в виде ионов, а слабые электролиты, газы и малорастворимые вещества − в виде молекул. Степень окисления атомов не используют, а учитывают заряды реальных ионов и характер среды, в которой идет процесс окисления или восстановления. Алгебраическую сумму зарядов в левой и правой частях полуреакций (процессов окисления и восстановления) уравнивают с помощью определенного числа электронов, которые участвуют в процессе. После записи полуреакций окисления и восстановления уравнивают число электронов, отданных восстановителем и принятых окислителем с помощью дополнительных коэффициентов (как в методе электронного баланса). С учетом этих коэффициентов записывают сокращенное ионно-молекулярное уравнение, а затем и молекулярное уравнение ОВР. Используем метод полуреакций для той же реакции:
Чтобы связать 4 моль атомов кислорода, требуется 8 моль атомов водорода (процесс идет в кислой среде):
Уравниваем алгебраическую сумму зарядов слева и справа:
Чтобы получить 1 моль атомов кислорода для окисления SO32-до SO42-, требуется 1 моль молекул H2O (процесс идет в кислой среде):
Уравниваем алгебраическую сумму зарядов слева и справа:
Теперь уравниваем число электронов в полуреакциях окисления и восстановления и получаем сокращенное ионно - молекулярное уравнение ОВР:
Записываем молекулярное уравнение ОВР:
МЕТОДИКА ЭКСПЕРИМЕНТА И ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
|
||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 940; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.009 с.) |





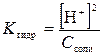
 ,
, откуда
откуда