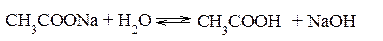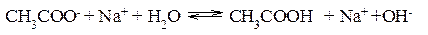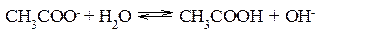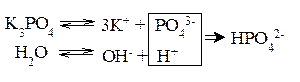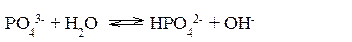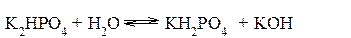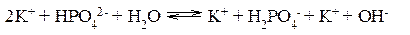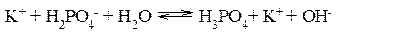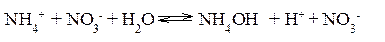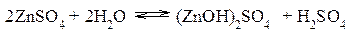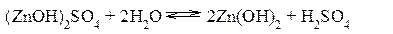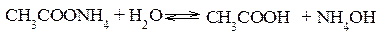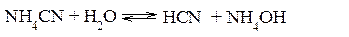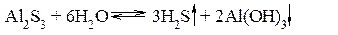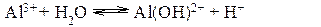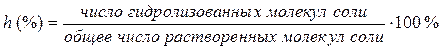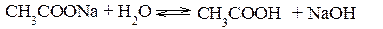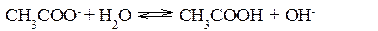Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 3. Установление зависимости буферной ёмкости раствора от разбавленияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
1. Приготовьте два ацетатных буферных раствора с одинаковым соотношением концентраций составляющих его компонентов, но с разной суммарной концентрацией. В пробирке № 1 приготовьте 10 мл буферного раствора с соотношением концентраций ацетата натрия и уксусной кислоты, равным 1:9, отмеряя рассчитанные объемы веществ при помощи пипетки. В пробирку № 2 поместите при помощи пипетки 1,0 мл раствора из пробирки № 1 и добавьте 8,0 мл дистиллированной воды (точно), после чего раствор перемешайте. В обе пробирки добавьте по 2 капли раствора метилового оранжевого. Наблюдаемую окраску запишите в таблицу 3. 2. Сравните буферную ёмкость приготовленных растворов при добавлении к ним небольшого количества щелочи. К растворам в обеих пробирках добавьте по 5 капель раствора гидроксида натрия с концентрацией 0,1 моль/л. Растворы перемешайте, наблюдаемую окраску запишите в таблицу 3. 3. Сделайте вывод о зависимости буферной ёмкости раствора от разбавления.
Таблица 3 − Наблюдения изменения окраски буферных растворов при установлении зависимости буферной ёмкости раствора от разбавления
Опыт 4. Определение буферной ёмкости раствора по кислоте и 1. Приготовьте испытуемые буферные растворы и растворы-свидетели. В колбах № 1 и № 3 приготовьте по 20 мл испытуемого ацетатного буферного раствора с равными молярными концентрациями компонентов (5:5). В колбах № 2 и № 4 приготовьте буферные растворы-свидетели с соотношением концентраций соли и кислоты, равными: в колбе № 2 1:9 и в колбе № 4 9:1. 2. Определите буферную ёмкость по кислоте. В колбы № 1 и № 2 добавьте по 5 капель метилового оранжевого, растворы перемешайте и наблюдаемую окраску запишите в таблицу 4. Испытуемый раствор в колбе № 1 оттитруйте соляной кислотой до получения окраски, одинаковой с окраской раствора-свидетеля. Результаты титрования отметьте в таблице 11. Буферную ёмкость В а (моль/л) рассчитайте по формуле
Величины для расчета рН определялись в задании 1.
3. Определите буферную ёмкость по основанию. В колбы № 3 и № 4 добавьте по 5 капель метилового красного, растворы перемешайте и наблюдаемую окраску запишите в таблицу 4. Испытуемый раствор в колбе № 3 оттитруйте раствором гидроксида натрия до получения окраски, одинаковой с окраской раствора-свидетеля. Результат титрования запишите в таблицу 4. Буферную ёмкость В в рассчитайте по формуле
где Величины для расчета рН определялись в задании 1.
Таблица 4 – Результаты определения буферной емкости растворов по кислоте и основанию
Контрольные вопросы и задания 1. Какие растворы называют буферными? 2. Для чего используются буферные растворы? 3. Что входит в состав буферных растворов? Приведите примеры. 4. На чем основано действие буферных растворов? 5. Зависит ли рН буферных растворов от соотношения концентраций 6. Что называется буферной емкостью раствора? 7. От чего зависит буферная емкость? 8. Приведите формулу расчета буферной емкости раствора по кислоте (по основанию).
Лабораторная работа № 5
ГИДРОЛИЗ СОЛЕЙ
Цель работы Изучить условия протекания процессов гидролиза солей и влияние факторов, обуславливающих смещение ионного равновесия при гидролизе.
ОСНОВНЫЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
Гидролизом соли называется обменная реакция взаимодействия соли с водой, приводящая к смещению равновесия диссоциации воды и, как правило, к изменению кислотности среды. Гидролизу могут подвергаться только те соли, ионы которых способны связывать Н+ или ОН–- ионы воды в малодиссоциированные соединения, т.е. соли, образованные слабыми кислотами и (или) слабыми основаниями. Соли, образованные сильными кислотами и сильными основаниями, гидролизу не подвергаются. В результате гидролиза солей образуется либо кислота (кислая соль) и основание, либо основание (основная соль) и кислота. Следовательно, процесс гидролиза соли можно рассматривать как процесс, обратный реакции нейтрализации. Так как реакции нейтрализации обычно идут практически до конца, то равновесие реакции гидролиза смещено в сторону реагирующих веществ. Концентрация продуктов гидролиза соли, как правило, мала. Гидролиз солей, образованных сильным основанием и слабой кислотой Реакция среды при гидролизе соли, образованной сильным основанием и слабой кислотой, – щелочная (pH>7). Гидролиз ацетата натрия CH3COONa В водном растворе:
Ионы CH3COO– и H+ связываются, образуя слабую малодиссоциированную уксусную кислоту и вызывая смещение равновесия диссоциации воды вправо, в сторону увеличения концентрации OH–. Уравнение реакции гидролиза ацетата натрия:
В ионной форме:
Гидролиз фосфата калия K3PO4 Эта соль образована сильным основанием и трехосновной слабой кислотой. Гидролиз солей, образованных многоосновными слабыми кислотами, проходит ступенчато: I ступень:
II ступень:
III ступень:
Наиболее полно гидролиз протекает по I ступени и практически не протекает по второй и третьей. В растворе при обычных условиях обнаруживаются лишь продукты гидролиза по I ступени. Лишь при условиях, особо благоприятствующих гидролизу, можно обнаружить продукты II и III ступеней гидролиза. Гидролиз солей, образованных слабым основанием и сильной кислотой Реакция среды при гидролизе соли, образованной слабым основанием и сильной кислотой, – кислая (рН<7). Гидролиз нитрата аммония NH4NO3 Нитрат аммония диссоциирует на ионы NO3– и ионы NH4+. Ионы NH4+ связывают ионы OH– воды, вызывая смещение равновесия диссоциации воды в сторону увеличения концентрации H+- ионов в растворе.
Уравнение гидролиза в молекулярной форме:
В ионной форме:
Гидролиз сульфата цинка ZnSO4 Сульфат цинка образован сильной кислотой и слабым двухкислотным основанием. Гидролиз этой соли может протекать по 2 ступеням, хотя при обычных условиях практически ограничивается лишь I ступенью. I ступень:
II ступень:
Гидролиз солей, образованных слабым основанием и слабой кислотой Подобные соли легче других подвергаются гидролизу, так как ионы этих солей одновременно связываются обоими ионами воды с образованием двух слабых электролитов. Реакция среды в растворах таких солей зависит от относительной силы кислоты и основания, т.е. водные растворы таких солей могут иметь нейтральную, кислую или щелочную реакцию в зависимости от констант диссоциации образующихся кислот и оснований. Гидролиз ацетата аммония CH3COONH4 Соль CH3COONH4 образована слабым основанием NH4OH и слабой кислотой CH3COOH одинаковой силы. К дис.NH4OH =1.8∙10-5; К дис.CH3COOH =1.8∙10-5. Реакция гидролиза в молекулярной форме:
В ионно-молекулярной форме:
Поскольку концентрация ацетат-ионов и ионов аммония в растворе одинаковы, а константы диссоциации кислоты и основания равны, то реакция среды будет нейтральной (рН=7). В результате реакции гидролиза цианида аммония NH4CN (К дис.HCN =7.2∙10-10; К дис.NH4OH =1.8∙10-5)
среда будет слабощелочной (рН>7). Гидролиз соли, образованной слабым многокислотным основанием и слабой многоосновной кислотой, например, Al2S3. Уравнение реакции гидролиза этой соли:
Ион алюминия связывает ион гидроксила
а сульфид-ион связывает ионы водорода:
В результате в растворе нет накопления ни ионов H+, ни ионов OH–, гидролиз протекает до полного разложения соли с образованием продуктов Al(OH)3 и H2S. Степень гидролиза Количественно процесс гидролиза можно характеризовать степенью гидролиза h (%).
Основные факторы, влияющие на степень гидролиза соли: − природа соли (чем более слабым электролитом образована данная соль, тем в большей степени она подвержена гидролизу); − концентрация соли (по мере уменьшения концентрации соли ее гидролиз усиливается, так как гидролиз соли лимитирован ничтожным количеством H+ и OH–-ионов, образующихся при диссоциации воды. Чем больше ионов воды приходится на долю ионов соли, тем полнее идет гидролиз); − температура (с увеличением температуры диссоциация воды несколько возрастает, что благоприятствует протеканию гидролиза); − добавление кислоты, щелочи или других солей (влияние добавления в раствор соли кислоты, основания или другой соли можно определить исходя из принципа Ле-Шателье. В том случае, когда добавляемые электролиты связывают продукты гидролиза соли, гидролиз соли усиливается. Если же добавляемый электролит увеличивает концентрацию продуктов гидролиза или связывает исходные вещества, то гидролиз соли уменьшается). Например:
Прибавление к этому раствору щелочи, т.е. ионов OH–, или другой соли, образованной слабой кислотой и сильным основанием, смещает равновесие гидролиза в сторону реагирующих веществ, а добавление кислоты, т.е. ионов H+, или соли, образованной сильной кислотой и слабым основанием, смещает равновесие гидролиза в сторону продуктов реакции.
МЕТОДИКА ЭКСПЕРИМЕНТА И ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 523; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.32.243 (0.007 с.) |

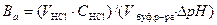
 где
где 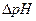 – изменение рН испытуемого буферного раствора в процессе добавления соляной кислоты
– изменение рН испытуемого буферного раствора в процессе добавления соляной кислоты
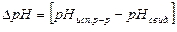 .
.