
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Опыт 1. Зависимость скорости химической реакции от концентрации реагирующих веществСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Зависимость скорости химической реакции от концентрации реагирующих веществ изучим на реакции взаимодействия тиосульфата натрия с серной кислотой:
Получающаяся тиосерная кислота неустойчива и легко разлагается:
Суммарно процесс можно представить так:
О прохождении реакции можно судить по изменению прозрачности раствора. В результате реакции выделяется свободная сера, что вызывает его помутнение. Для исследования влияния концентрации одного из реагирующих веществ на скорость данной реакции следует провести ее несколько раз, варьируя концентрацию раствора одного исходного реагента, но оставляя концентрацию второго реагента постоянной. Изменяя концентрацию тиосульфата натрия, замерим время от момента слива растворов до начала помутнения. По этому промежутку времени (τ) будем судить об относительной скорости химической реакции. Ход работы 1. В пять пробирок пипеткой ( на 10мл) наберите по 10 мл раствора 2%-й серной кислоты. 2. В пять других пробирок пипетками (на 5мл) наберите раствор 2%-го тиосульфата натрия и воду в количествах, указанных в таблице 4 (пипетки не путать!) 3. Попарно сливая приготовленные растворы тиосульфата натрия и серной кислоты в химический стакан, замерьте по секундомеру время от момента слива растворов до начала помутнения. Время запишите в таблицу 4. Раствор с осадком вылейте, стакан тщательно вымойте, сполосните дистиллированной водой и проводите в нем следующий опыт. 4. Рассчитайте относительные скорости проведенных пяти реакций по формуле:
Результаты опытов запишите в таблицу 1. 5. Рассчитайте относительную концентрацию Na2S2O3 по формуле
где а – объем раствора Na2S2O3, мл; b – объем раствора Н2SO4, мл; с – объем Н2О, мл. Результаты опытов запишите в таблицу 1. 6. Постройте график зависимости относительной скорости реакции от относительной концентрации Na2S2O3. 7. Сделайте вывод о влиянии концентрации на скорость реакции. Отметьте характер зависимости скорости данной реакции от концентрации (прямая, проходящая через начало координат, парабола). Каков порядок изучаемой реакции по данному реагенту? Сделайте обобщенный вывод о том, как меняется скорость реакции с увеличением концентрации реагирующих веществ.
Таблица 1 – Результаты опытов по определению зависимости скорости химической реакции от концентрации исходных реагентов
|
|||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-12-10; просмотров: 470; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.83.45 (0.009 с.) |


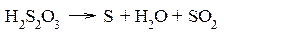
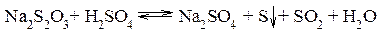
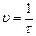 .
.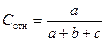 ,
,


