
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Возможность и условия протекания реакцииСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте при различных сочетаниях знаков D rH и D rS
Пример 1.3.4. Пользуясь справочными данными, установите, возможно ли восстановление оксида титана(IV) до свободного металла по схеме: TiO2 (к) + 2С (графит) = Ti (к) + 2СО (г) при температурах 298 K и 2500 K. Зависимостью D rH и D rS от температуры пренебречь. Решение. 1) Вывод о возможности (невозможности) протекания реакции сделаем, проанализировав величину изменения энергии Гиббса в результате процесса. Для ее расчета воспользуемся уравнением Δ rG о = Δ rH o– T Δ rS o. 2) В приложении 1 найдем значения стандартных энтальпий образования и энтропий веществ:
3) Рассчитаем стандартные значения изменения энтальпии и энтропии реакции при 298 K:
4) Рассчитаем стандартное изменение энергии Гиббса данной реакции при 298 K:
Поскольку 5) Рассчитаем
Вопросы для самостоятельной подготовки
1. Дайте определение понятиям: «система», «фаза», «окружающая среда». 2. Какие системы называются гомогенными, а какие – гетерогенными? 3. Что такое «параметр состояния», «функция состояния»? 4. Рассмотрите смысл понятий «внутренняя энергия системы» и «энтальпия». Приведите примеры реакций, у которых D H = D U и D H ≠ D U. 5. Какие факторы определяют величину изменения энтальпии реакции? Как зависит эта величина от энергии активации, пути и условия протекания процесса, присутствия катализаторов? 6. Могут ли быть экзотермичными процессы диссоциации молекул на атомы, ионы; эндотермичными – процессы образования молекул из атомов, радикалов, из других молекул? 7. Объясните смысл понятия «энтальпия образования вещества». Сформулируйте условия стандартизации этой характеристики. Чем отличаются стандартные условия от нормальных? 8. Сформулируйте закон Гесса. Какова связь между тепловым эффектом (энтальпией) реакции и энтальпией образования исходных веществ и продуктов реакции? 9. Дайте объяснение понятия «энтропия». 10. Не проводя расчетов, определите знак изменения энтропии в ходе следующих процессов: а) 2H2 (г) + O2 (г) = 2H2O (г); б) 2H2S (г) + 3O2 (г) = 2H2O (ж) + 2SO2 (г); в) MgO (к) + CO2 (г) = MgCO3 (к); г) лед ® вода ® пар; д) CH3COOH (р-р) = CH3COOˉ (р-р) + H+ (р-р). 11. Дайте определение понятия «энергия Гиббса». 12. Каково соотношение между величиной изменения энергии Гиббса и величинами изменения энтальпии и энтропии системы? 13. Как D rG химической реакции используется в качестве критерия самопроизвольности ее протекания? 14. Возможны ли случаи, когда реакции с D rG < 0 практически не идут? Дайте объяснение. 15. Учитывая роль энтальпийного и энтропийного факторов и температуры в определении величины D rG, выделите четыре общих типа реакций, различающихся возможностью и температурными условиями их самопроизвольного протекания. Задачи и упражнения 141. Поясните смысл понятий: «стандартные условия», «стандартное состояние», «стандартное значение термодинамической величины». 142. Что называют внутренней энергией системы? Почему в термодинамических расчетах используют не абсолютные значения внутренней энергии U, а ее изменение D U при переходе системы из одного состояния в другое? 143. Что называют тепловым эффектом реакции? Какие уравнения химических реакций называют термохимическими? Какой закон является основным законом термохимии? Дайте его формулировку. 144. Что называют энтальпией? Какая связь существует между изменением энтальпии и тепловым эффектом химического процесса? 145. Какой функцией состояния характеризуется тенденция системы к достижению так называемого наиболее вероятного состояния, которому соответствует максимальная беспорядочность распределения частиц? 146. Как изменяется энтропия системы с повышением температуры; в реакциях синтеза и разложения веществ? 147. Как изменяется энтропия системы при испарении, конденсации, увеличении давления, фазовых переходах? 148. Какими одновременно действующими факторами определяется направленность химического процесса? 149. При соединении железа массой 2,1 г с серой выделилось 3,77 кДж. Рассчитайте энтальпию образования сульфида железа(II). 150. Определите стандартную энтальпию образования ( 2PH3 (г) + 4О2 (г) = Р2О5 (к) + 3Н2О (ж); 151. Исходя из теплового эффекта реакции: 6СаО (к) + Р4О10 (к) = 2Са3(РО4)2 (к); определите 152. Вычислите и сравните а) Fe2O3 (к) + 3H2 (г) = 2Fe (к) + 3H2O (г); б) Fe2O3 (к) + 3С(графит) = 2Fe (к) + 3СО (г); в) Fe2O3 (к) + 3СО (г) = 2Fe (к) + 3СО2 (г). 153. Вычислите значения а) С6Н12О6 (к) = 2С2Н5ОН (ж) + 2СО2 (г); б) С6Н12О6 (к) + 6О2 (г) = 6СО2 (г) + 6Н2О (ж). Какая из этих реакций поставляет организму больше энергии? 154. Не производя вычислений, установите знак D rS о следующих процессов: а) 2NH3 (г) = N2 (г) + 3H2 (г); б) СО2 (к) = СО2 (г); в) 2NO (г) + O2 (г) = 2NO2 (г); г) 2H2S (г) + 3O2 (г) = 2H2O (ж) + 2SO2 (г); д) 2СH3OH (г) + 3O2 (г) = 4H2O (г) + 2СО2 (г). 155. Не производя вычислений, укажите, для каких из перечисленных процессов изменение энтропии положительно: а) СuO (к) + H2 (г) = Cu (к) + H2O (ж); б) С(графит) + СО2 (г) = 2СО (г); в) СН3СООН (р-р) = СН3СОО– (р-р) + Н+ (р-р); г) 4НCl (г) + О2 (г) = 2Cl2 (г) + 2Н2О (г); д) NH4NO3 (к) = N2O (г) + 2Н2О (г)? 156. Установите, протекание каких из нижеследующих реакций возможно в стандартных условиях при 25 оС: а) N2 (г) + ½ О2 (г) = N2O (г); б) 4HCl (г) + О2 (г) = 2Cl2 (г) + 2Н2О (ж); в) Fe2O3 (к) + 3СО (г) = 2Fe (к) + 3СО2 (г)? 157. Какие из нижеприведенных реакций и при каких температурах (высоких или низких) могут протекать самопроизвольно: а) 2N2 (г) + О2 (г) = 2N2O (г); б) N2 (г) + О2 (г) = 2NO (г); в) 2NO (г) + O2 (г) = 2NO2 (г); г) NO (г) + NO2 (г) = N2O3 (г); д) N2 (г) + 2О2 (г) = 2NO2 (г);
1.4. ОСНОВЫ ХИМИЧЕСКОЙ КИНЕТИКИ. Факторы, влияющие на скорость Скорость гомогенной реакции – это величина, численно равная изменению молярной концентрации любого из веществ, участвующих в реакции в единицу времени. Средняя скорость реакции v срв интервале времени от t 1до t 2
Основные факторы, влияющие на скорость гомогенной химической реакции: · природа (состав и строение) реагирующих веществ; · концентрации реагентов; · давление (если в реакции участвуют газы); · температура; · наличие катализатора. Все химические реакции по стадийности подразделяются на элементарные (одностадийные) и сложные (многостадийные). Большинство химических реакций представляет собой сложные процессы, протекающие в несколько стадий, т. е. состоящие из нескольких элементарных процессов. Для элементарных реакций справедлив закон действующих масс: скорость химической реакции при данной температуре прямо пропорциональна произведению концентраций реагирующих веществ в степенях, равных соответствующим стехиометрическим коэффициентам. Для элементарной реакции а А + b B →... ее скорость согласно закону действующих масс выражается уравнением:
где с (А)и с (В) — молярные концентрации реагирующих веществАиВ; k – константа скорости данной реакции. Физический смысл константы скорости:она численно равна скорости химической реакции при концентрациях реагентов c (А)и c (В) = 1 моль/дм3. Величина константы скорости гомогенной реакции зависит от природы реагирующих веществ, температуры и наличия катализатора. Большинство химических реакций являются сложными, протекающими через множество промежуточных стадий. В таком случае закон действующих масс применим только к каждой отдельной стадии, а скорость реакции в целом определяется скоростью самой медленной уу стадии. В случае гетерогенных реакций в уравнение закона действующих масс входят концентрации не всех реагентов, а только газообразных или растворенных. Так, для реакции горения угля С (к) + О2 (г) → СО2 (г) уравнение скорости имеет вид Пример 1.4.1. Константа скорости реакции 2NO (г) + O2 (г) → 2NO2 (г) при некоторой температуре равна 0,8. Рассчитайте: а) начальную скорость реакции, если начальные концентрации реагирующих веществ равны: c 0(NO) = 0,4 моль/дм3, c 0(O2) = 0,3 моль/дм3; б) скорость этой реакции в момент, когда количество NO в системе уменьшится на 25 %. Решение. 1) Рассчитаем скорость данной реакции в первоначальный момент (v 0), подставив в выражение закона действующих масс начальные концентрации (c 0) веществ:
2) Найдем изменение концентрации оксида азота(II) Δ c (NO): Поскольку количество NO уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Поэтому: Δ c (NO) = 0,25 ∙ c 0(NO) = 0,25 ∙ 0,4 моль/дм3 = 0,1 моль/дм3. 3) Из уравнения реакции найдём соответствующее изменение концентрации кислорода: Δ c (O2) = Δ c (NO): 2 = 0,1: 2 = 0,05 моль/дм3. 4) Найдем новые концентрации (с 1) реагирующих веществ: с 1(NO) = с 0(NO) – Δ c (NO) = 0,4 – 0,1 = 0,3 моль/дм3; с 1(O2) = с 0(O2) – Δ c (O2) = 0,3 – 0,05 = 0,25 моль/дм3. 5) Рассчитаем новое значение скорости реакции:
Пример 1.4.2. Как изменится скорость реакции 2NO (г) + Cl2 (г) → 2NOCl (г), если: а) увеличить давление в реакционном сосуде в 2 раза; б) уменьшить объем сосуда в 4 раза? Решение. 1) Обозначив начальные концентрации NO и Cl2 как с 0(NO) и с 0(Cl2), запишем выражение для скорости реакции в начальный её момент:
2) Поскольку давление в системе увеличивается в 2 раза, концентрации всех газообразных веществ в ней также увеличиваются в 2 раза и составляют: c 1(NO) = 2 c 0(NO), c 1(Cl2) = 2 c 0(Cl2). 3) Учитывая, что константа скорости реакции k при увеличении давления не изменяется, подставим найденные новые значения концентраций c 1(NO) и c 1(Cl2) в выражение закона действующих масс:
= 8 · k · c 02(NO) · c0(Cl2). 4) Найдем, во сколько раз v 1 больше v 0:
Следовательно, при увеличении давления в системе в 2 раза скорость реакции увеличится в 8 раз. 5) Поскольку при уменьшении объема сосуда в 4 раза концентрации всех содержащихся в нем газов увеличиваются в 4 раза, новые концентрации NO и Cl2 будут равны: c 1(NO) = 4· c 0(NO), a c 1(Cl2) = 4· c 0(Cl2). 6) Выполнив подстановку и расчеты, как в пунктах 3 и 4, получим Влияние температуры на скорость химической реакции Зависимость скорости реакции от температуры приближенно
где С помощью правила Вант-Гоффа можно лишь примерно оценить влияние температуры на скорость реакции. Более точное описание зависимости скорости реакции от температуры осуществимо в рамках теории активации Аррениуса. В теории активации влияние температуры и катализатора на скорость химической реакции описывается следующим уравнением для константы скорости химической реакции:
где А – постоянный множитель, не зависящий от температуры, определяющийся природой реагирующих веществ; R – молярная газовая постоянная; Е а – энергия активации реакции; е – основание натуральных логарифмов. Как следует из уравнения Аррениуса, константа скорости реакции тем больше, чем меньше энергия активации реакции. Пример 1.4.3. Температурный коэффициент скорости химической реакции равен 2,1. Во сколько раз возрастет скорость этой реакции при увеличении температуры в реакционном сосуде от 15 оС до 38 оС? Решение: В соответствии с правилом Вант-Гоффа:
Примечание. Если в вашем калькуляторе отсутствует кнопка возведения в степень, то такие арифметические вычисления можно осуществлять через стадии логарифмирования и последующего потенциирования:
Химическое равновесие Химические реакции, в результате которых исходные вещества полностью превращаются в продукты реакции, называются необратимыми. Они осуществляются только в одном направлении. Реакции, идущие одновременно в двух противоположных направлениях (прямом и обратном), называются обратимыми. В момент начала обратимой реакции концентрации исходных веществ максимальны, а концентрации продуктов реакции равны 0. С течением времени концентрации исходных веществ и скорость прямой реакции постепенно уменьшаются, а концентрации продуктов и скорость обратной реакции постепенно увеличиваются. Однако через определенное время наступает такое состояние системы, при котором скорости прямой и обратной реакции оказываются одинаковыми ( В момент, когда устанавливается равновесие, изменение концентраций всех веществ прекращается. Концентрации веществ, находящихся в равновесной системе, называются равновесными концентрациями (с р). В общем случае для любой обратимой реакции а А + b B ↔ d D + e E, независимо от ее механизма, выполняется соотношение:
При установившемся равновесии произведение равновесных концентраций продуктов реакции, отнесенное к произведению концентраций исходных веществ, для данной реакции при данной температуре представляет собой постоянную величину, называемую константой равновесия (K). Пример 1.4.4. Найдите величину константы химического равновесия реакции 2А (г) + В (г) ↔ 2D (г), если начальные концентрации веществ А и В были равны соответственно 0,6 моль/дм3 и 0,4 моль/дм3, а к моменту наступления равновесия количество вещества В уменьшилось на 25 %. Рассчитайте изменение давления в системе по сравнению с первоначальным, если в исходной смеси вещество D отсутствовало. Решение. 1) Запишем выражение константы равновесия для данной реакции:
2) Определим равновесную концентрацию вещества В: Поскольку к моменту наступления равновесия количество вещества В в системе уменьшилось на 25 %, то и его концентрация также уменьшилась на 25 %. Следовательно, D с (В) = 0,25 ∙ с 0(В) = 0,25 ∙ 0,4 = 0,1 моль/дм3. Тогда равновесная концентрация вещества В равна: c р(В) = c 0(В) – D c (В) = 0,4 – 0,1 = 0,3 моль/дм3. 3) Определим равновесную концентрацию вещества А: В соответствии с уравнением реакции D c (А) = 2D c (В) = 2 · 0,1 = 4) Определим равновесную концентрацию вещества D: В соответствии с уравнением реакции количество образовавшегося вещества D равно количеству прореагировавшего вещества А, поэтому D c (D) = 0,2 моль/дм3. Так как в первоначальный момент вещество D отсутствовало, то равновесная концентрация D равна: c р(D) = 0 + D c (D) = 0 + 0,2 = 0,2 моль/дм3. 5) Подставим найденные равновесные концентрации веществ А, В и D в выражение для константы равновесия и рассчитаем искомую величину K:
6) Поскольку давление в системе в начальный момент реакции (р 0) и в момент наступления равновесия (р 1) пропорционально суммарной концентрации газообразных веществ, можно записать:
Таким образом, давление в равновесной системе будет составлять 90 % от исходной величины. Пример 1.4.5. В системе А (г) + В (г) ↔ 2D (г) равновесные концентрации равны: c р(А) = 0,4 моль/дм3; c р(В) = 0,9 моль/дм3; c р(D) = Решение. 1) Запишем выражение константы равновесия для данной реакции и рассчитаем ее величину:
2) Учитывая, что в момент начала реакции вещество D отсутствовало, найдем изменения концентраций (Δ с) веществ А и В. Из уравнения реакции следует, что на образование 2 моль вещества D необходимо по 1 моль веществ А и В. Поскольку концентрация образовавшегося вещества D равна 0,6 моль/дм3, то концентрации исходных веществ А и В уменьшились на 0,3 моль/дм3, т. е. Δ с (А) = Δ с (В) = 0,3 моль/дм3. 3) Найдем начальные концентрации исходных веществ: c 0(А) = c р(А) + Δ с (А) = 0,4 + 0,3 = 0,7 моль/дм3; c 0(В) = c р(В) + Δ с (В) = 0,9 + 0,3 = 1,2 моль/дм3. Влияние изменения внешних условий на положение Изменение условий (температуры, давления, концентраций), при которых система находится в состоянии химического равновесия ( Направление смещения химического равновесия в результате изменения внешних условий определяется принципом Ле Шателье: Если на систему, находящуюся в состоянии химического равновесия, оказывается внешнее воздействие, то равновесие сместится в сторону той из двух противоположных реакций, которая ослабляет это воздействие. Пример 1.4.6. В какую сторону сместится положение химического равновесия в системе CaCO3 (к) «CaO (к) + CO2 (г); а) при введении в систему углекислого газа; б) при введении в систему оксида кальция; в) при увеличении давления; г) при увеличении температуры? Решение. В соответствии с принципом Ле Шателье равновесие в системе сдвигается таким образом, чтобы уменьшить внешнее воздействие. Поэтому: а) введение углекислого газа приводит к повышению концентрации CO2. Для ослабления этого воздействия равновесие в системе должно сместиться влево; б) введение твердого оксида кальция не изменяет концентрацию СаО в фазе СаО (к), и химическое равновесие не смещается; в) увеличение давления приводит к увеличению концентрации CO2 (г) и практически никак не влияет на концентрации твердых компонентов. Равновесие сдвигается влево; г) увеличение температуры может быть компенсировано эндотермическим процессом. Поскольку с поглощением тепла протекает прямая реакция, равновесие в системе смещается вправо.
Вопросы для самостоятельной подготовки Скорость химических реакций 1. Что называется скоростью химической реакции? 2. Какие факторы влияют на скорость химической реакции? 3. Как скорость химической реакции зависит от концентраций реагентов? Сформулируйте основной закон химической кинетики – закон действующих масс – и укажите условия его применения. 4. Напишите математические выражения закона действующих масс для следующих реакций: а) 2NOCl (г) = 2NO (г) + Cl2 (г); б) Fe2O3 (к) + H2 (г) = 2FeO (к) + H2O (г). 5. От каких факторов зависит величина константы скорости реакции? Каков ее физический смысл? 6. Каково влияние давления на скорость химической реакции? 7. Как влияет повышение (понижение) температуры на скорость химической реакции? 8. Что такое температурный коэффициент скорости химической реакции? 9. Почему скорость химической реакции с повышением температуры возрастает намного быстрее, чем число столкновений молекул? 10. Какие молекулы называются активными? 11. Что такое энергия активации и активированный комплекс? 12. Каково соотношение величин энергии химических связей в реагирующих молекулах и энергии активации реакции? 13. Приведите энергетическую диаграмму химической реакции и отобразите на диаграмме энергию активации и тепловой эффект реакции. Как объяснить, что тепловой эффект реакции не зависит от ее энергии активации? 14. Как влияет величина энергии активации на скорость химической реакции? 15. Возможны ли реакции с энергией активации, равной нулю? 16. Какова взаимосвязь между константой скорости реакции и энергией активации? 17. Каково влияние величины энергии активации на температурный коэффициент скорости реакции? 18. Какие вещества называются катализаторами? 19. В чем заключается ускоряющее действие катализатора? 20. Каково влияние катализатора на величину энергии активации химической реакции? Поясните с использованием энергетической диаграммы. 21. На примере объясните сущность теории промежуточных продуктов. 22. В чем состоит особенность ферментативных реакций? Химическое равновесие 23. Какое состояние системы называется химическим равновесием? 24. Как определить момент наступления химического равновесия? 25. Можно ли считать постоянство концентраций реагентов в системе доказательством истинности химического равновесия? 26. Что такое константа химического равновесия? Каков ее физический смысл? 27. Запишите математические выражения констант равновесия для систем: а) 4HCl (г) + O2 (г) «2Cl2 (г) + 2H2O (г) б) 2Fe (к) + 3Cl2 (г) «2FeCl3 (к) 28. Каково влияние температуры, давления, концентрации и присутствия катализатора на величину константы химического равновесия? 29. Каково влияние температуры, давления, концентрации и присутствия катализатора на состояние химического равновесия? 30. Сформулируйте принцип Ле Шателье. 31. В какую сторону сместится равновесие 2NO (г) + O2 (г) «2NO2 (г); а) уменьшении давления; б) введении в систему кислорода; в) повышении температуры? 32. В каком направлении произойдет смещение равновесия Fe3O4 (к) + 4H2 (г) «3Fe (к) + 4H2O (г) при: а) введении в систему водорода; б) введении в систему прокаленного оксида кальция; в) увеличении давления? 33. Какие реакции относятся к фотохимическим? 34. Приведите примеры неразветвленных и разветвленных цепных реакций. 35. Каково значение фотохимических реакций для живой природы? Задачи и упражнения 158. Напишите математические выражения закона действующих масс для реакций: а) А (г) + 2В (г) = АВ2 (г); в) 2А (р-р) + В (р-р) = А2В (р-р); б) А (г) + В (к) = АВ (г); г) А (р-р) + В (к) = D (р-р) + E (к). 159. Рассчитайте, как изменится скорость реакции 2А (г) + В (г) = 2С (г), если: а) увеличить концентрацию вещества А в 3 раза; б) уменьшить концентрацию вещества В в 4 раза; в) увеличить давление в системе в 2 раза; г) увеличить объем системы в 3 раза? 160. Начальные концентрации реагентов равны: с 0(А) = 0,06 моль/дм3 и с 0(В) = 0,10 моль/дм3. Рассчитайте, как изменится скорость реакции 2А (г) + В (г) → 2D (г) по сравнению с первоначальной в тот момент, когда количество вещества В в системе уменьшится на 10 %? 161. В сосуд объемом 2 дм3 ввели кислород массой 0,32 г и оксид азота(II) массой 0,30 г. Рассчитайте, как изменится скорость реакции 2NO (г) + О2 (г) → 2NO2 (г) по сравнению с первоначальной в тот момент, когда количество NO в системе уменьшится на 20 %? 162. Температурный коэффициент скорости реакции равен 2. Рассчитайте, как изменится ее скорость, если в системе: а) увеличить температуру от –2 оС до 38 оС; б) понизить температуру от 25 оС до –5 оС; в) увеличить температуру от 22 оС до 45 оС? 163. При повышении температуры на 40 оС скорость реакции возрастает от 0,025 моль/(дм3· с) до 0,8 моль/(дм3· с). Определите температурный коэффициент скорости данной реакции. 164. При понижении температуры в системе от x оС до y оС скорость реакции уменьшилась от 0,027 моль/(дм3· с) до 0,001 моль/(дм3· с). Определите величину температурного коэффициента скорости данной реакции, если: а) x = 22, y = –8; б) x = 50, y = 22; в) x = –5, y = –45. 165. На сколько градусов и как необходимо изменить температуру в системе, чтобы скорость реакции увеличилась в 100 раз, если температурный коэффициент равен 3,1? 166. В какую сторону сместится равновесие в системах: а) H2 (г) + I2 (г) ↔ 2HI (г); б) N2 (г) + О2 (г) ↔ 2NO (г); в) 2СО (г) + О2 (г) ↔ 2СО2 (г); г) 2Н2О (г) ↔ 2Н2 (г) + О2 (г); при увеличении давления; при увеличении объема системы; при охлаждении системы? 167. Напишите математические выражения констант равновесия для систем: а) N2 (г) + О2 (г) ↔ 2NO (г); б) CH3COOH (р-р) ↔ H+ (р-р) + CH3COO– (р-р); в) CuO (к) + Н2 (г) ↔ Cu (к) + Н2О (г); г) 2NO (г)+ О2 (г) ↔ 2NO2 (г); д) [Ag(CN)2]–(р-р) ↔ Ag+(р-р) + 2CN–(р-р). 168. Стандартная энтальпия образования PCl5 (г) равна 464 кДж/моль. Какие условия необходимо создавать для увеличения практического выхода PCl5 при его синтезе из простых веществ? 169. Химическое равновесие 2NO (г) + О2 (г) ↔ 2NO2 (г) установилось при концентрациях оксида азота(II), кислорода и оксида азота(IV), равных соответственно 0,08; 0,03 и 0,02 моль/дм3. Вычислите константу равновесия и начальные концентрации оксида азота(II) и кислорода, если в исходной системе оксид азота(IV) отсутствовал. 170. Вычислите константу равновесия реакции N2O4 (г) ↔ 2NO2 (г), если начальная концентрация N2O4 была 0,06 моль/дм3, а к моменту наступления равновесия его количество уменьшилось на 50 %. Оксид NO2 в первоначальный момент реакции отсутствовал. 171. Найдите константу равновесия реакции N2 (г) + 3H2 (г) ↔ 2NH3 (г), если начальные концентрации азота и водорода были равны соответственно 0,2 и 0,6 моль/дм3, а к моменту наступления равновесия количество азота в системе уменьшилось на 20 %. Как изменилось давление в системе при переходе от ее начального состояния к равновесному, если аммиак в исходной смеси отсутствовал? 172. При некоторой температуре константа равновесия гомогенной системы N2 (г) + 3H2 (г) ↔ 2NH3 (г) равна 1. Равновесные концентрации водорода и аммиака равны соответственно 0,2 и 0,08 моль/дм3. Вычислите равновесную и начальную концентрации азота, если в исходной смеси аммиак отсутствовал. 173. При некоторой температуре константа равновесия обратимой реакции FeO (к) + CO (г) ↔ Fe (к) + CO2 (г) равна 0,5. Найдите равновесные концентрации СО и СО2, если их начальные концентрации были равны соответственно 0,05 и 0,01 моль/дм3. 174. Константа равновесия СО2 (г) + Н2 (г) ↔ СО (г) + Н2О (г) при некоторой температуре равна 1. Определите, на сколько процентов уменьшится количество СО2 в системе к моменту наступления равновесия, если начальные количества СО2 и Н2 были равны соответственно 1 моль и 3 моль? (CO и Н2О в начале реакции отсутствовали). 175. Константа равновесия в системе СО2 (г) + Н2 (г) ↔ СО (г) + Н2О (г) при некоторой температуре равна 1. Определите, в каком объемном соотношении были смешаны СО2 и Н2, если к моменту наступления равновесия количество водорода уменьшилось на 80 %? (CO и Н2О в начале реакции отсутствовали). 176. Константа равновесия в системе Н2 (г) + Br2 (г) ↔ 2HBr (г) при некоторой температуре равна 1. Определите объемные доли компонентов равновесной системы, если количества водорода и брома до начала реакции составляли соответственно 0,3 моль и 0,2 моль. (HBr в исходной смеси отсутствовал). 177. В замкнутом сосуде протекает реакция АВ (г) ↔ А (г) + В (г). Константа равновесия равна 0,04, а равновесная концентрация вещества А составляет 0,02 моль/дм3. Найдите начальную концентрацию вещества АВ и степень его разложения. 178. Пользуясь справочными данными, определите константу равновесия системы 2NO2 (г) ↔ N2O4 (г) при 25 оС исходя из изменения энергии Гиббса реакции.
1.5. КОЛИЧЕСТВЕННЫЙ СОСТАВ РАСТВОРОВ Раствор – это гомогенная система, состоящая из двух или более веществ. Вещества, составляющие раствор, называются компонентами раствора. Растворы бывают газообразные, жидкие и твердые. Для биологии и медицины наибольший интерес представляют жидкие водные растворы. Любой раствор состоит из растворенных веществ и растворителя, хотя эти понятия в известной степени условны. Обычно растворителем считается тот компонент, который в растворе находится в том же агрегатном состоянии, что и до его образования. Например, в водном растворе глюкозы (твердое вещество) растворителем является вода, а смесь спирта (жидкость) и воды (жидкость) можно назвать в зависимости от количества компонентов раствором спирта в воде или раствором воды в спирте. В растворах электролитов вне зависимости от соотношения компонентов и их агрегатного состояния электролиты всегда рассматриваются как растворенные вещества. Свойства растворов определяются их качественным и количественным составом. На практике для выражения количественного состава растворов используют следующие величины: а) безразмерные – массовая, объемная и мольная доли; б) размерные – массовая концентрация, молярная концентрация, молярная концентрация эквивалентов вещества и моляльность. Массовая доля растворенного вещества – w – физическая величина, численно равная отношению массы растворенного вещества m (Х) к общей массе раств |
||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1562; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

 , кДж/моль
, кДж/моль
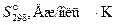
 = 2 · (–110,5) – (–943,9) = 722,9 кДж = 722900 Дж;
= 2 · (–110,5) – (–943,9) = 722,9 кДж = 722900 Дж; = 30,6 + 2 ∙ 197,5 – 50,3 – 2 ∙ 5,7 = 363,9 Дж/K.
= 30,6 + 2 ∙ 197,5 – 50,3 – 2 ∙ 5,7 = 363,9 Дж/K. = 722900 – 298 · 363,9 = 614458 Дж.
= 722900 – 298 · 363,9 = 614458 Дж. > 0, восстановление TiO2 при 298 K невозможно.
> 0, восстановление TiO2 при 298 K невозможно.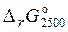 . Если в соответствии с условием пренебречь зависимостью
. Если в соответствии с условием пренебречь зависимостью  и
и  от температуры, то:
от температуры, то: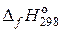 ) РН3, исходя из уравнения:
) РН3, исходя из уравнения: = –2360 кДж.
= –2360 кДж. = –1478 кДж,
= –1478 кДж, .
. ,
, .
. моль/(дм3 ∙ с).
моль/(дм3 ∙ с).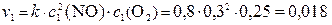 моль/(дм3 ∙ с).
моль/(дм3 ∙ с).
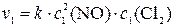 =
=  =
= .
.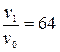 , т. е. уменьшение объема сосуда в 4 раза приведет к увеличению скорости реакции в 64 раза.
, т. е. уменьшение объема сосуда в 4 раза приведет к увеличению скорости реакции в 64 раза. ,
, – скорости реакции соответственно при температурах Т 2 и Т 1;γ– температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость данной реакции при повышении температуры на каждые 10°. Он вычисляется для каждой реакции из экспериментальных данных и в большинстве случаев принимает значения от 2 до 4. При ∆ Т ≤ 100 о значение γ практически не зависит от температуры, т. е. является для данной реакции постоянной величиной.
– скорости реакции соответственно при температурах Т 2 и Т 1;γ– температурный коэффициент скорости реакции, который показывает, во сколько раз увеличивается скорость данной реакции при повышении температуры на каждые 10°. Он вычисляется для каждой реакции из экспериментальных данных и в большинстве случаев принимает значения от 2 до 4. При ∆ Т ≤ 100 о значение γ практически не зависит от температуры, т. е. является для данной реакции постоянной величиной.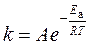 ,
, ;
;  = 5,5.
= 5,5. , а
, а  .
. ). Такое состояние называется состоянием химического равновесия.
). Такое состояние называется состоянием химического равновесия. .
. .
.
 .
.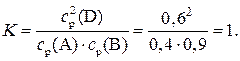
 ) c течением времени в системе устанавливается новое химическое равновесие
) c течением времени в системе устанавливается новое химическое равновесие  , соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом, или смещением положения равновесия.
, соответствующее новым условиям. Переход из одного равновесного состояния в другое называется сдвигом, или смещением положения равновесия.


