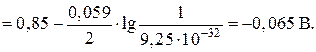Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Из всех возможных овр наиболее вероятной будет та реакция, которой соответствует максимальное значение разности потенциалов применяемых окислителя и восстановителя.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Пример 1.9.7. Используя значения E 0 полуреакций, определите наиболее вероятный продукт восстановления иодат-ионов сернистой кислотой: а) IO3‾ + 6H+ + 6ē → I‾ + 3H2O, E о= 1,08 В; б) IO3‾ + 6H+ + 5ē → 1/2I2 + 3H2O, E о= 1,19 В; в) IO3‾ + 5H+ + 4ē → HIO + 2H2O, E о = 1,14 В; г) SO42‾ + 4H+ + 2ē → H2SO3 + H2O, E о= 0,17 В. Решение. 1.Поскольку значение потенциала полуреакции г) меньше значений потенциалов полуреаций а), б) и в), то сульфит-ионы будут являться восстановителями по отношению к иодат-ионам. 2.Для каждой из полуреакций а), б) и в) найдем разность между ее потенциалом и потенциалом полуреакции г): E o(а) – E o(г) = 1,08 В – 0,17 В = 0,91 В; E o(б) – E o(г) = 1,19 В – 0,17 В = 1,02 В; E o(в) – E o(г) = 1,14 В – 0,17 В = 0,97 В. 3.Видно, что максимальное значение Δ E o соответствует разности между потенциалами полуреакций б) и г). Следовательно, сернистая кислота будет восстанавливать иодат-ионы до свободного иода. Чем больше значение Δ Е реакции, тем больше значение константы химического равновесия и тем сильнее оно смещено в сторону образования продуктов. Пример 1.9.8. Рассчитайте значение константы химического равновесия реакции окисления сульфата железа(II) перманганатом калия в сернокислом растворе, в котором концентрации всех потенциалопределяющих ионов равны 1 моль/дм3. Решение. 1.Составим уравнение данной ОВР, расставим коэффициенты методом электронного баланса и найдем значение n. 2KMnO4 + 10FeSO4 + 8H2SO4 = 5Fe2(SO4)3 + 2MnSO4 + K2SO4 + 8H2O
Из уравнений электронного баланса видно, что число электронов, отданных восстановителем и принятых окислителем, т. е. число n, 2.Найдем потенциалы полуреакций окисления ионов железа (а) и восстановления перманганат-ионов в кислой среде (б): а) 3.Рассчитаем значение Δ E o реакции: Δ E о = 4.Вычислим значение константы равновесия:
Такое огромное значение константы равновесия свидетельствует о том, что данная реакция протекает слева направо практически необратимо. Влияние различных факторов на направление Окислительно-восстановительная реакция протекает в том направлении, в котором осуществляется полуреакция с более высоким значением потенциала. Поэтому факторы, влияющие на величину потенциала, оказывают воздействие и на направление протекания ОВР. К таким факторам относятся: 1. Концентрация потенциалопределяющих ионов; 2. Величина рН раствора; 3. Температура раствора; 4. Величина ПР малорастворимого продукта реакции; 5. Величина константы нестойкости образующегося комплексного иона. Рассмотрим характер влияния каждого из этих факторов на направление протекания ОВР.
Влияние концентраций потенциалопределяющих ионов
Изменяя значения концентраций ионов в растворе, можно изменить направление протекания ОВР. Пример 1.9.9. Определите направление протекания реакции Sn0 + Pb2+ ↔ Sn2+ + Pb0 при следующих значениях концентраций ионов: а) с (Pb2+) = 1 моль/дм3; с (Sn2+) = 1 моль/ дм3; б) с (Pb2+) = 0,15 моль/ дм3; с (Sn2+) = 1,5 моль/ дм3. Решение. 1.Рассчитаем значения равновесных электродных потенциалов для случая а) и определим направление реакции:
Аналогично рассчитаем потенциал пары
Поскольку электродный потенциал пары 2.Рассчитаем равновесные потенциалы для случая б) и определим направление реакции:
В данном случае электродный потенциал больше у пары
Влияние величины рН раствора
Изменяя значение рН раствора, можно изменить направление протекания ОВР, если в ней принимают участие ионы Н+ или ОН–. Пример 1.9.10. Изменится ли направление протекания реакции в системе K3AsO4 + KI + H2SO4 ↔ K3AsO3 + I2 + K2SO4 + H2O при изменении рН раствора от 0 до 8, если концентрации ионов AsO43–, AsO33–, I– и молекул I2 в растворе равны 1 моль/дм3? Решение. 1.Данная ОВР осуществляется благодаря протеканию двух полуреакций: а) AsO4 3– + 2H+ + 2ē → AsO33– + H2O; E о = 0,57 В; б) I2 + 2ē → 2I–; E о = 0,54 В. Поскольку в полуреакции а) принимают участие ионы водорода, ее потенциал зависит от величины рН раствора. В полуреакции б) ионы Н+ не участвуют, поэтому ее потенциал не зависит от величины рН. 2.Рассчитаем потенциал полуреакции а) при рН, равном 0, и определим направление ОВР. Если рН раствора равно 0, то концентрация ионов водорода равна 1 моль/дм3. Тогда:
Поскольку при рН, равном 0, потенциал полуреакции а) больше потенциала полуреакции б), арсенат-ионы будут проявлять окислительные, а иодид-ионы – восстановительные свойства, и указанная реакция в целом протекает слева направо. 3. Рассчитаем потенциал полуреакции а) при рН, равном 8, и определим направление ОВР. Если рН раствора равен 8, то концентрация ионов водорода составляет 1 · 10–8 моль/ дм3. Тогда
Поскольку при рН, равном 8, потенциал полуреакции «а» меньше потенциала полуреакции б), то арсенит-анионы Влияние температуры на направление протекания ОВР
Из уравнения Нернста следует, что величина электродного потенциала зависит и от значения температуры. Поэтому, изменяя температуру раствора, можно изменить направление протекания некоторых ОВР. Пример 1.9.11. Покажите, как влияет изменение температуры от 25 oС до 90 oС на направление протекания реакции: Na2Cr2O7 + 14HCl ↔ 3Cl2 + 2CrCl3 + 2NaCl + 7H2O, если концентрации ионов Cr2O72– и Cr3+ равны 1 моль/дм3, концентрация соляной кислоты равна 1,32 моль/дм3, а парциальное давление хлора – 101,325 кПа. Решение. 1.Указанная реакция состоит из двух полуреакций: а) Cr2O72– + 14H+ + 6ē → 2Cr3+ + 7H2O, E о = 1,333 В; б) Сl2 + 2ē → 2Cl–, E о = 1,359 В. 2.Рассчитаем потенциалы полуреакций а) и б) при температуре 25 оС и определим направление протекания ОВР: а)
б)
В данном случае разность потенциалов Δ E (1,352 В – 1,350 В) оказалась меньше 0,4 В, поэтому в системе устанавливается химическое равновесие. Но, учитывая более высокое значение потенциала полуреакции б), делаем вывод, что при 25 oС более сильными окислительными свойствами обладает хлор и что указанное равновесие смещено влево. 3.Рассчитаем потенциалы полуреакций при 90 oС и определим направление смещения равновесия: а)
б)
Таким образом, при температуре 90 oС более высокое значение потенциала у полуреакции а). Это значит, что более сильные окислительные свойства в данном случае проявляют ионы Влияние величины ПР малорастворимого продукта
Если в результате ОВР образуется малорастворимый продукт, то концентрация образующих его ионов в растворе резко уменьшается. Вследствие этого изменяется потенциал соответствующей полуреакции, что может привести к изменению направления ОВР. Пример 1.9.12. Определите направление протекания реакций при 25 oС в системах: а) 2Ag + 2HCl ↔ H2 + 2AgCl; б) 2Ag + 2HI ↔ H2 + 2AgI, если концентрации хлороводорода и иодоводорода в растворе составляет 1 моль/дм3, а давление водорода равно 101,325 кПа. Решение. 1.Рассчитаем концентрацию ионов серебра в растворе над осадком AgCl, допустив, что концентрация хлорид-ионов в растворе равна концентрации НCl и составляет 1 моль/дм3: c (Ag+) = 2.Рассчитаем равновесный потенциал пары
3.Определим направление реакции а): Поскольку в указанных условиях потенциал водорода равен 0, а потенциал пары 4.Рассчитаем концентрацию ионов серебра в растворе над осадком AgI, допустив, что концентрация иодид-ионов в растворе равна концентрации HI и составляет 1 моль/дм3: c (Ag+) = 5.Рассчитаем равновесный потенциал пары
6.Определим направление реакции б). Поскольку в растворе HI потенциал пары пары Влияние комплексообразования на направление протекания ОВР Если в результате ОВР образуются комплексные соединения, в которых роль комплексообразователя играют потенциалопределяющие ионы, то концентрация этих ионов в растворе резко уменьшается. Вследствие этого потенциалы соответствующих полуреакций изменяются, что может привести к изменению направления ОВР. Пример 1.9.13. Определите направление протекания реакций при 25 оС в системах: а) Hg + 4HBr ↔ H2 + H2[HgBr4]; б) Hg + 4HI ↔ H2 + H2[HgI4], если концентрации HBr и HI в растворах равны 2 моль/дм3, концентрации ионов [HgBr4]2– и [HgI4]2– составляют 1 моль/ дм3, давление водорода равно 101,325 кПа. Решение. 1.Рассчитаем концентрацию катионов Hg2+, образующихся в результате диссоциации анионов [HgBr4]2–. При этом допускаем, что общая концентрация ионов Br– в растворе равна концентрации HBr и составляет 2 моль/дм3: K нест ([HgBr4]2–)= Отсюда: 2.Рассчитаем равновесный потенциал
3. Рассчитаем потенциал
4.Определим направление протекания реакции а). Поскольку в данном случае более высоким является потенциал 5.Рассчитаем концентрацию ионов Hg2+, образующихся в результате диссоциации ионов [HgI4]2–. При этом допускаем, что общая концентрация ионов I– в растворе равна концентрации HI и составляет 2 моль/дм3: K нест [HgI4]2– = Отсюда:
6.Рассчитаем равновесный потенциал
7. Определим направление протекания реакции б). Поскольку в данном случае более высоким является значение потенциала По этой же причине медь вытесняет водород из водных растворов цианидов.
Вопросы для самостоятельной подготовки
1. Что такое степень окисления а. ч.? Какие значения она может принимать? Чему равна сумма степеней окисления атомов в молекуле; в ионе? 2. Какие реакции относятся к окислительно-восстановительным? 3. В чем заключаются с точки зрения электронной теории процессы окисления и восстановления? Как изменяются значения степеней окисления атомов в результате этих процессов? 4. Как зависят окислительно-восстановительные свойства веществ от значений степеней окисления а. ч., входящих в их состав? 5. Перечислите типичные восстановители. 6. Какие вещества являются типичными окислителями? 7. Приведите примеры веществ, которые в зависимости от условий могут проявлять как окислительные, так и восстановительные свойства? Как это можно объяснить? 8. Как классифицируются окислительно-восстановительные реакции? Чем отличаются реакции межмолекулярного окисления-восстановления от реакций внутримолекулярного окисления-восстановления; реакции диспропорционирования от реакций конпропорционирования? 9. Что является количественной характеристикой окислительно-восстановительных свойств веществ? Что представляет собой стандартный электродный (окислительно-восстановительный) потенциал? 10. Какие потенциалы называются равновесными? Как они связаны со стандартными электродными потенциалами? От каких факторов зависит величина равновесного потенциала? 11. Как связаны окислительно-восстановительные свойства веществ со значениями электродных потенциалов соответствующих полуреакций? 12. Как оценивается принципиальная возможность протекания ОВР в указанном направлении? 13. Как определяется направление протекания ОВР? 14. Как можно определить наиболее вероятную ОВР из нескольких возможных реакций? 15. Какова зависимость константы химического равновесия ОВР от значений электродных потенциалов полуреакций? 16. Какие факторы оказывают влияние на направление протекания ОВР? Охарактеризуйте влияние каждого из них. 17. Какова роль окислительно-восстановительных реакций в процессах жизнедеятельности? 18. В чем заключается принципиальное отличие ОВР, протекающих в живых организмах, от ОВР, протекающих в неживой природе? Задачи и упражнения 284. Методом электронного баланса расставьте коэффициенты в уравнениях ОВР, укажите окислитель и восстановитель: а) Al + HNO3 → Al(NO3)3 + NH4NO3 + H2O; б) Mg + H2SO4 → MgSO4 + H2S + H2O; в) FeS2 + O2 + K2CO3 → KFeO2 + K2SO4 + CO2; г) KI + H2SO4 → I2 + H2S + KHSO4 + H2O; д) P2S3 + HNO3 + H2O → H3PO4 + H2SO4 + NO; е) KClO3 + NH3 + KOH → KCl + KNO3 + Н2О; ж) FeS + HNO3 → Fe2(SO4)3 + Fe(NO3) + NO2 + H2O; з) I2 + Ba(OH)2 → BaI2 + Ba(IO3)2 + H2O; и) P4 + Sr(OH)2 → PH3 + Sr(H2PO2)2 + H2O; к) MnCl2 + KMnO4 + H2O → MnO2 + KCl + HCl; л) MnCl2 + PbO2 + H2SO4 → PbSO4 + HMnO4 + Cl2 + H2O; м) Al + HClO3 → AlCl3 + Al(ClO3)3 + H2O; н) CrI2 + O3 + KOH → O2 + K2CrO4 + KIO3 + H2O; о) Fe3O4 + KOH + Cl2 → K2FeO4 + KCl + H2O; п) H2O2 + KBiO3 + H2SO4 → O2 + Bi2(SO4)3 + K2SO4 + H2O; р) Fe(OH)2 + NO2 → Fe(NO3)3 + NO + H2O; с) As2S3 + H2SO4 (конц) → H3AsO4 + SO2 + H2O; т) Fe(NO3)2 → Fe2O3 + NO2 + O2; у) Mn + KNO3 + KOH → K2MnO4 + KNO3 + H2O; ф) KMnO4 + C2H5OH + H2SO4 → CO2 + K2SO4 + MnSO4 + H2O; х) CrO3 + C2H5OH + H2SO4 → CH3CHO + Cr2(SO4)3 + Н2О; ц) Al(NO3)3 + Al + HCl → NH4Cl + AlCl3 + H2O; ч) Fe(CrO2)2 + Na2CO3 + O2 → Fe2O3 + Na2CrO4 + CO2; ш) AgNO3 + Zn + H2SO4 → Ag + (NH4)2SO4 + ZnSO4 + H2O; щ) Fe(NO3)3 + Fe + NaOH → Na2FeO4 + NO + H2O. 285. Допишите формулы продуктов, расставьте коэффициенты, укажите окислитель и восстановитель: а) I2 + Cl2 + H2O → HIO3 + …; б) Sr(OH)2 + Br2 → Sr(BrO3)2 + …; в) KMnO4 + PH3 + H2SO4 → H3PO4 + …; г) H3AsO4 + Al + H2SO4 → AsH3 + …; д) Ca(ClO)2 + HCl → Cl2 + …; е) KClO3 + P4S6 → P4O10 + SO3 + …; ж) PbO2 + KI + H2SO4 → HIO3 + H2O + …; з) Na2Cr2O7 + S + H2SO4 → Cr2(SO4)3 + Na2SO4 + …. 286. Определите направление протекания в стандартных условиях следующих реакций: а) H2O2 + HOCl ↔ HCl + O2 + H2O; б) H3PO4 +2 HI ↔ H3PO3 + I2 + H2O; в) 2FeCl3 + Cu ↔ 2FeCl2 + CuCl2; г) SnCl4 + 2KI ↔ SnCl2 +I2 + 2KCl; д) H2SO3 + Cl2 + H2O ↔ H2SO4 + 2HCl. 287. Какие из указанных реакций могут протекать в стандартных условиях: а) MnO4– + Ag0 → MnO42– + Ag+; б) MnO4– + 3Ag0 + 2H2O → MnO2 + 3Ag+ + 4OH–; в) MnO4– + 8H+ + 5Ag0 → Mn2+ + 5Ag++ 4H2O? 288. В водном растворе с (Hg2+) = 0,01 моль/дм3, c (Fe3+) = 0,01моль/дм3, c (Fe2+) = 0,001 моль/ дм3. Какая из реакций может протекать в этом растворе самопроизвольно: а) 2FeCl3 + Hg → 2FeCl2 + HgCl2; б) HgCl2 + 2FeCl2 → Hg + 2FeCl3? 289. Закончите уравнения реакций дисмутации, расставьте коэффициенты: а) K2SO3 → K2S + …; б) HClO3 → ClO2 + …; в) P4O6 + H2O → PH3 + …; г) NO2 + Ca(OH)2 → Ca(NO2)2 + …; д) Se + KOH → K2SeO3 + …. 290. Закончите уравнения реакций конмутации, расставьте коэффициенты: а) SO2 + H2S → б) Ca(ClO3)2 + HCl (конц) → в) H2S + H2SO4 (конц) → г) KMnO4 + MnSO4 + H2O → д) NH2OH + N2O5 →. 291. Можно ли хлоридом железа(III) в растворе окислить сульфид натрия до серы; до сульфита натрия; до сульфата натрия? Проведите соответствующие расчеты. Составьте уравнение возможной ОВР. 292. Определите реакции,которые могут протекать самопроизвольно при стандартных условиях: а) H3PO3 + I2 + H2O → H3PO4 + … б) H3PO3 + AgNO3 +H2O → Ag0 + … в) H3PO3 + Cd(NO3)2 + H2O → Cd0 + … г) H3PO3 + Hg(NO3)2 + H2O → Hg0 + …. Закончите уравнения возможных реакций, расставьте коэффициенты. 293. Можно ли при стандартных условиях приготовить раствор, содержащий одновременно: а) FeCl3 и KI; г) Cl2 и CrCl2; б) CuSO4 и NaBr; д) Cu(NO3)2 и ВаI2; в) H2O2 и H2S; е) K2Сr2O7 и K2SO4? Приведите соответствующие расчеты. Составьте уравнения возможных ОВР. 294. Рассчитайте значения констант равновесия реакций в стандартных условиях: а) SnCl4 + 2FeCl2 ↔ SnCl2 + 2FeCl3; б) 2Fe(NO3)3 + Hg2(NO3)2 ↔ 2Hg(NO3)2 + 2 Fe(NO3)2. В какой из данных реакций происходит более полное восстановление ионов олова? 295. Какие из указанных ниже веществ могут проявлять только окислительные свойства; только восстановительные; как окислительные, так и восстановительные свойства: а) KMnO4; MnO2; V2O5; KI; б) PbO2; NH3; KNO2; (NH4)2S; в) K2SO3; HNO3; CaCrO4; P4O6? 296. Оцените принципиальную возможность протекания ОВР между веществами: а) HNO3 и P2O5; г) H2S и NH3; б) H2S и H2SO4 (конц); д) SnO и CrO3; в) K2Cr2O7 и HClO4; е) СH2O и O2. Напишите уравнения возможных ОВР, расставьте коэффициенты. 297. В каком направлении протекают указанные реакции в стандартных условиях: а) NO3– + Cr3+ + H2O ↔ NO + Cr2O72– + H+; б) Fe2+ + MnO4– + H+ ↔ Fe3+ + Mn2+ + H2O; в) Co2+ + MnO4– + H+ ↔ Co3+ + Mn2+ + H2O? 298. Можно ли использовать оксид свинца(IV) в присутствии серной кислоты в качестве окислителя для осуществления в стандартных условиях следующих реакций: а) I2 + 6H2O – 10ē → 2IO3– + 12H+; б) Mn2+ + 4H2O – 5ē → MnO4– + 8H+; в) Sn2+ – 2ē → Sn4+; г) Co2+ – ē → Co3+ ? 299. Определите ЭДС и направление протекания реакции в системе 2Co2+ + Pb4+ ↔ 2Co3+ + Pb2+, если концентрации ионов равны: c (Co2+) = 1·10–1 моль/дм3; c (Co3+) = 1·10–5 моль/ дм3; c (Pb2+) = 1·10–4 моль/ дм3; c (Pb4+) = 1·10–2 моль/ дм3. 300. Как изменяются при понижении рН растворов величины окислительно-восстановительных потенциалов следующих полуреакций: а) MnO4ˉ + 8H+ + 5ē → Mn2+ + 4H2O; б) Fe3+ + ē → Fe2+; в) CrO42– +4H2O + 3ē → Cr(OН)3 + 5OH–? 301. Какая из реакций наиболее вероятна в стандартных условиях: а) SnCl4 + Fe → SnCl2 + FeCl2; б) SnCl4 + 2Fe → Sn + 2FeCl2? Ответ подтвердите соответствующими расчетами. 302. Могут ли в стандартных условиях протекать реакции: а) Ag + H2SO4 (разб) → Ag2SO4 + H2; б) Fe + FeCl3 → FeCl2; в) Cu + Fe2(SO4)3 → CuSO4 + FeSO4; г) Hg + HCl → H2 + HgCl2? Приведите соответствующие расчеты. 303. С помощью соответствующих расчетов покажите, как изменится потенциал полуреакции Cr2O72– + 14H+ + 6ē → 2Cr3+ +7H2O при увеличении рН раствора от 0 до 2, если концентрации ионов Cr2O72– и Cr3+ равны 1 моль/ дм3? 304. Какой из окислителей – KMnO4., PbO2 или K2Cr2O7 при стандартных условиях является наиболее эффективным по отношению к HCl при получении хлора? Проведите соответствующие расчеты, составьте уравнения реакций с участием указанных окислителей, расставьте коэффициенты. 305. Электродный потенциал цинка, помещенного в раствор нитрата цинка, равен –0,85 В. Вычислите молярную концентрацию ионов цинка в данном растворе. 306. Определите наиболее вероятные продукты реакций в стандартных условиях: а) KMnO4 + K2S + H2O → б) NaNO2 + NaI + HCl → в) H2O2 + HI →. 307. В какой среде перманганаты проявляют наиболее сильные окислительные свойства? Почему? Составьте уравнения ОВР взаимодействия перманганата калия с сульфитом натрия в разных средах, расставьте коэффициенты. 308. Допишите приведенные ниже схемы, в которых указаны ионы только исходных веществ. Подберите коэффициенты и напишите соответствующие уравнения реакций в молекулярной форме: а) Fe3+ + Iˉ → б) Сr2O72– + NO2– + H+ → в) NO3ˉ + Zn + H+ →. 309. Рассчитайте массу перманганата калия, необходимого для приготовления раствора объемом 0,5 дм3 с молярной концентрацией эквивалентов данной соли 0,025 моль/ дм3, если известно, что приготовленный раствор будет использован для окисления в нейтральной среде. 310. Вычислите молярную концентрацию эквивалентов дихромата калия в растворе с массовой долей его 10 % и плотностью раствора 1,07 г/ см3, если дихромат-ионы в условиях опыта восстанавливаются до Cr3+. 311. Подкисленные растворы каких из перечисленных веществ нельзя хранить в открытой посуде во избежание окисления их кислородом воздуха: а) бромида натрия; г) фосфата аммония; б) иодида калия; д) сульфата олова(II); в) хлорида железа(II); е) сульфида натрия? Почему?
1.10. КОМПЛЕКСНЫЕ СОЕДИНЕНИЯ Комплексными (координационными) называются соединения, в узлах кристаллических решеток которых находятся комплексные частицы, способные к самостоятельному существованию в растворах. Эти частицы образованы за счет координации электронодефицитным атомом или катионом (акцептором электронов) электронейтральных частиц или анионов (доноров электронов). Cтроение и состав комплексных соединений Строение комплексных соединений (КС) объясняется координационной теорией А. Вернера. Основные ее положения следующие: 1) Центральное место в любой комплексной частице занимает атом-комплексообразователь («центральный атом»). 2) Вокруг атома-комплексообразователя в определенном порядке расположены (координированы) одно- или многоатомные частицы – лиганды (адденды). 3) Комплексообразователь и лиганды образуют комплексную частицу, или внутреннюю сферу комплексного соединения, которую принято записывать в квадратных скобках. 4)Ионы, не входящие во внутреннюю сферу, составляют внешнюю сферу комплексного соединения. Общий заряд внешней сферы всегда равен заряду внутренней сферы. Комплексообразователями могут быть атомные частицы металлов и неметаллов с вакантными орбиталями на внешних энергетических уровнях. Наиболее типичные комплексообразователи –катионы и атомы d -элементов IV периода таблицы Периодической системы, и в особенности, Cr, Co, Ni, Cu, Zn, Fe. Лигандами являются одно- и многоатомные частицы с неподеленными парами электронов. К наиболее типичным лигандам относятся молекулы (NH3, H2O, CO) и анионы (OH–, СN–, NO2–, Hal–, NCS–, S2O32–, C2O42–, CO32–). Важнейшая характеристика любого комплексообразователя – его координационное число (КЧ). Оно представляет собой общее число всех атомов, непосредственно связанных с атомом-комплексообразователем в комплексной частице. Координационные числа комплексообразователей могут принимать значения от 2 до 12, но чаще всего они равны 2; 4 и 6. Согласно эмпирическому правилу Вернера координационное число катиона-комплексообразователя равно его удвоенному заряду. Хотя это правило выполнимо для большого числа комплексных соединений, есть и исключения из него (табл. 3). Таблица 3
|
||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 1660; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.32.238 (0.015 с.) |

 + 5ē →
+ 5ē → 
 – 1ē →
– 1ē → 
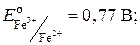 б)
б) 
 –
–  = 1,51 В – 0,77 В = 0,74 В.
= 1,51 В – 0,77 В = 0,74 В. .
.
 :
:
 больше потенциала пары
больше потенциала пары  , то ионы свинца являются окислителями по отношению к олову и указанная реакция протекает слева направо.
, то ионы свинца являются окислителями по отношению к олову и указанная реакция протекает слева направо.



 будут проявлять восстановительные, а молекулы I2 – окислительные свойства. Это значит, что в данных условиях указанная реакция протекает справа налево.
будут проявлять восстановительные, а молекулы I2 – окислительные свойства. Это значит, что в данных условиях указанная реакция протекает справа налево.






 и равновесие реакции в целом смещено вправо.
и равновесие реакции в целом смещено вправо.
 в данном растворе:
в данном растворе:


 (равного 0), то серебро окисляется в указанных условиях ионами водорода и равновесие реакции б) практически полностью смещено вправо. Таким образом, металлическое серебро вытесняет водород из раствора иодоводородной кислоты.
(равного 0), то серебро окисляется в указанных условиях ионами водорода и равновесие реакции б) практически полностью смещено вправо. Таким образом, металлическое серебро вытесняет водород из раствора иодоводородной кислоты. .
.

 при данной концентрации ионов Hg2+:
при данной концентрации ионов Hg2+:

 , допустив, что концентрация ионов Н+ равна концентрации HI и составляет 2 моль/дм3:
, допустив, что концентрация ионов Н+ равна концентрации HI и составляет 2 моль/дм3:
 .
.