
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы. Экспериментально установлено, что любой газ химическим количеством 1 моль, содержащий 6,02∙1023 молекул, при нормальных условиях (н. у.) – температуре 0 оС или 273 K, и давлении 101,325 кПа – занимает объем, равный 22,4 дм3. Этот объем, отнесенный к количеству газа, равному 1 моль, называется молярным объемом газа при н. у. и обозначается символом
Следует помнить, что существует также понятие «молярный объем смеси газов». Эта величина обозначается Понятию «молярный объем газовой смеси» соответствует понятие «средняя молярная масса газовой смеси». Эта величина обозначается Физический смысл средней молярной массы газовой смеси: она численно равна массе смеси, в которой общее химическое количество газов равно 1 моль. Средняя молярная масса газовой смеси связана с молярными массами образующих ее газов соотношением Здесь φ(X) и φ(Y) – объемные доли газов в смеси, М (X) и M (Y) – молярные массы газов. Объемная доля газа (φ) в смеси – величина, равная отношению объема газа Х к объему смеси:
Как и массовая доля, она может выражаться в долях единицы или в процентах. Поскольку в воздухе φ(О2) ≈ 0,21, а φ(N2) ≈ 0,78, то средняя молярная масса воздуха ≈ 29 г/моль. Следует помнить, что объемные доли (φ) газов в смеси численно равны их мольным долям (χ):
2. Плотность газа – ρ – величина, численно равная отношению его молярной массы к молярному объему при н. у.: ρ(X)= Единицы плотности газов – г/дм3, кг/м3 и т. п. Например, плотность кислорода при н. у. равна: ρ(O2) = Физический смысл плотности газа в том, что она численно равна массе газа объемом 1 дм3 (н. у.). Существует также понятие «плотность газовой смеси». Эта величина обозначается ρ(см.) и рассчитывается по формуле
Например, плотность воздуха при н. у. равна:
3. Относительная плотность газа Х по газу Y (
Относительная плотность одного газа по другому – величина безразмерная. Физический смысл относительной плотности газа X по газу Y: она показывает, во сколько раз масса газа X при одних и тех же условиях больше массы газа Y, если их химические количества одинаковы:
Наиболее часто при решении задач используются значения относительных плотностей газов по водороду и по воздуху, которые рассчитываются по формулам:
Стехиометрические коэффициенты в уравнениях реакций между газами пропорциональны объемам данных газов, участвующих в этих реакциях. Для реакции a A(г) + b B(г) = c C(г)справедливо соотношение: a: b: c = V (A): V (B): V (C). Закон Бойля – Мариотта «При постоянной температуре произведение давления данной порции газа и его объема есть величина постоянная». Математическое выражение данного закона:
где V 1 и V 2 – объемы газа при давлениях р 1 и р 2. Физический смысл этого закона в том, что при увеличении давления газа в определенное число раз его объем уменьшается во столько же раз и наоборот. При решении задач закон Бойля – Мариотта используется для расчета объема газа V 2 при давлении р 2, если известен объем газа V 1 при давлении р 1:
Пример 1.1.12. При некоторой температуре и давлении 98,5 кПа объем газа равен 10,4 дм3. Вычислите объем данной порции газа при той же температуре и давлении 162,6 кПа. Решение. Из уравнения Бойля–Мариотта выразим V 2 и найдем его
Закон Шарля – Гей-Люссака Т.Э.Д. 247. Напишите уравнения электролитической диссоциации следующих веществ: HNO3, H3PO4, H2SO4, CH3COOH, Ba(OH)2, Al(OH)3, Al2(SO4)3, KHSO4, Ba(OH)NO3, Fe(OH)Сl2. 248. Напишите в молекулярной и ионно-молекулярных формах уравнения реакций, протекающих в водных растворах между следующими соединениями: а) BaCl2 + Al2(SO4)3 → д) KHS + H2SO4 → б) Fe(OH)SO4 + BaCl2 → е)AgCl + NaI → в) CaCO3 + CH3COOH → ж) FeCl3 + Na4[Fe(CN)6] → г) Ca(HCO3)2 + HNO3 → з) Fe(NO3)2 + K3[Fe(CN)6] → 249. Определите молярные концентрации ионов в водных растворах следующих веществ с указанными значениями их молярных концентраций: HNO3 (0,1 моль/дм3); H2SO4 (0,05 моль/дм3); Ba(OH)2 (0,01 моль/дм3); AlCl3 (0,15 моль/дм3); Al2(SO4)3 (0,25 моль/дм3). 250. Используя справочные данные, рассчитайте молярные концентрации частиц Н+, NO2–, HNO2 в водном растворе азотистой кислоты, если ее общая молярная концентрация равна 1,2 моль/дм3. 251. Общая молярная концентрация слабой двухосновной кислоты в растворе равна 4,3 · 10–3 моль/дм3. Рассчитайте константу диссоциации указанной кислоты по первой стадии, если соответствующая ей степень диссоциации составляет 10 %? 252. При какой молярной концентрации уксусной кислоты в растворе доля ее непродиссоциировавших молекул составляет 90 %? K (СH3COOH) = 1,8 ∙ 10–5. 253. Молярные концентрации кислот HCl, H2SO4, HCOOH, CH3COOH в их растворах составляют по 0,1 моль/дм3. Рассчитайте молярные концентрации ионов водорода в этих растворах. 254. В раствор объемом 1,0 дм3 с молярной концентрацией CH3COOH, равной 1 моль/дм3, пропустили хлороводород объемом 2,24 дм3 (н. у.). Как изменились при этом молярная концентрация ионов Н+ и степень диссоциации уксусной кислоты? (Изменением объема раствора при растворении газа пренебречь.) 255. Определите степень диссоциации уксусной кислоты и молярную концентрацию ионов Н+ в растворе с массовой долей CH3COOH, равной 10 % (r = 1,04 г/см3). 256. Определите pHи рОН растворов, в которых молярные концентрации ионов Н+ равны: 0,050; 4,10 ∙ 10–3; 8,70∙10–11 моль/дм3. 257. Определите pH и pOHрастворов, в которых молярные концентрации ионов ОН– равны: 0,040; 1,80 ∙ 10–5; 6,40 ∙ 10–12 моль/дм3. 258. Определите pHследующих водных растворов: а) 0,0020 М H2SO4; б) 0,0010 М Ba(OH)2. 259. Определите pHводного раствора серной кислоты, если 260. Определите pH и pOHводного раствора аммиака, в котором молярная концентрация гидрата аммиака равна 0,20 моль/дм3 NH3 ∙ H2O, а константа его диссоциации составляет 1,8 · 10–5. 261. Определите pH и pOH водного раствора уксусной кислоты, если w (CH3COOH) = 1,0 %, а плотность раствора составляет 1,02 г/см3. 262. Вычислите константу диссоциации слабой одноосновной кислоты, если ее молярная концентрация равна 0,20 моль/дм3, а рН раствора составляет 4,15. 263. Определите pH и pOHраствора, в котором молярная концентрация витамина C (слабой одноосновной аскорбиновой кислоты) составляет 0,15 моль/дм3. Константа диссоциации кислоты равна 8 ∙ 10–5. 264. Рассчитайтеконцентрацию ионов водорода в желудочном соке и в крови здорового человека, если pHэтих биологических жидкостей равен соответственно 1,5 и 7,4. 265. В раствор объемом 1,0 дм3 с молярной концентрацией уксусной кислоты, равной 0,20 моль/дм3, добавили твердый ацетат натрия массой 16,4 г. Как изменился при этом рН раствора? (Изменением объема раствора при добавлении соли пренебречь.) 266. Используя справочные данные (приложение 3), рассчитайте коэффициенты растворимости (моль/дм3 и г/дм3) солей AgCl, AgI и Ag2S. 267. Рассчитайте массу ионов Ag+, содержащихся в насыщенном растворе Ag2SO4 объемом 200 см3. 268. В насыщенном растворе PbCl2 объемом 200 см3 дополнительно растворили NaCl количеством 1,0 моль. Во сколько раз при этом уменьшилась молярная концентрация ионов Pb2+ в растворе? (Изменением объема раствора при растворении NaCl пренебречь). 269. В каком минимальном объеме воды можно растворить ортофосфат кальция массой 1 г, если ПР этой соли составляет 2,0 · 10–29? 270. Рассчитать массу иодида свинца(II), который может раствориться в воде объемом 5 дм3, если ПР данной соли составляет 1,1 · 10–9. 271. К раствору объемом 200 см3 с молярной концентрацией AgNO3, равной 2,5 ∙ 10–3 моль/дм3, добавили раствор объемом 300 см3, в котором молярная концентрация CaCl2 составляла 0,0050 моль/дм3. Образовался ли при этом осадок? 272. К раствору объемом 50 см3 с молярной концентрацией PbNO3)2, равной 2,5 ∙ 10–2 моль/дм3, добавили раствор объемом 150 см3, в котором молярная концентрация CaI2 составляла 0,0050 моль/дм3. Образовался ли при этом осадок? 273. К раствору объемом 250 см3 с молярной концентрацией AgNO3, равной 2,5 ∙ 10–3 моль/дм3, добавили раствор объемом 150 см3, в котором молярная концентрация Na2SO4 составляла 2,5 ∙ 10–2 моль/дм3. Образовался ли при этом осадок? 274. К раствору объемом 250 см3 с молярной концентрацией эквивалентов CaCl2, равной 2,2 ∙ 10–3 моль/дм3, добавили раствор объемом 250 см3, в котором молярная концентрация эквивалентов Na2SO4 составляла 4,4 ∙ 10–2 моль/дм3. Образовался ли при этом осадок? 275. Напишите уравнения гидролиза в ионно-молекулярных и молекулярной формах следующих солей: AlI3, K3PO4, ZnSO4, Al2(SO4)3, NH4CN, NH4HCO3, Al2Se3. Определите среду их растворов. 276. Какова среда водных растворов солей: NaHCO3, KHSO3, Cs2SO4, K2HPO4, RbH2PO4, НСООNH4, Ba(OH)Cl? Напишите уравнения возможных реакций. 277. Используя справочные данные, рассчитайте рН раствора сульфита натрия, если его молярная концентрация составляет 1,2 моль/дм3. 278. Используя справочные данные, рассчитайте рН раствора фосфата калия, если его молярная концентрация составляет 1,5 моль/дм3. 279. Используя справочные данные, рассчитайте рН раствора гидрокарбоната калия, если молярная концентрация его эквивалентов составляет 1,8 моль/дм3. 280. Известно, что среда водного раствора гидрофосфата натрия слабощелочная, а дигидрофосфата натрия – слабокислая. Содержащиеся в этих солях анионы могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–. Какой из этих процессов преобладает в указанных растворах? Ответ подтвердите, сравнив константы диссоциации ионов с соответствующими константами гидролиза солей. 281. Учитывая, что ионы 282. Сравните гидролизуемость солей в каждой паре, если их молярные концентрации в растворах одинаковы: а) FeCl2 – FeCl3; г) Be(NO3)2 – Mg(NO3)2; б) Na2CO3 – Na2SiO3; д) Na2CO3 – (NH4)2CO3; в) NaHCO3 – Na2CO3; е) Na2S – Na2Se. 283. Напишите в молекулярной и ионно-молекулярной формах уравнения совместного гидролиза карбоната натрия и следующих солей: а) хлорид железа(III); б) сульфат алюминия; в) нитрат хрома(III); г) сульфат меди(II). Будет ли изменяться состав продуктов при замене карбоната натрия на гидрокарбонат?
1.7. СТРОЕНИЕ АТОМА
Вопросы для самостоятельной подготовки 1. Перечислите и охарактеризуйте элементарные частицы, входящие в состав атомов. Какие из этих частиц относятся к нуклонам? 2. Дайте определение понятий: нуклид; протонное число; массовое (нуклонное) число; изотопы; изобары; изотоны. 3. Что общего в понятиях «нуклид» и «элемент» и чем они отличаются? Какие нуклиды называются радионуклидами? 4. Что такое радиоактивность? Каковы ее причины? Приведите примеры основных типов радиоактивных превращений. 5. Объясните причины и сущность корпускулярно-волновой двойственности микрообъектов. 6. Что такое электронное облако; волновая функция; электронная плотность; атомная орбиталь? В чем различие понятий орбиталь и орбита? 7. Какой смысл имеют квантовые числа, характеризующие состояние электрона в атоме? Какие численные значения они могут принимать? 8. Дайте толкование понятий: электронная оболочка; энергетический уровень; электронный слой; подуровень; атомная орбиталь. 9. Что такое эффективный заряд атомного ядра? 10. Поясните основные принципы распределения электронов по уровням, подуровням и орбиталям в атомах. 11. Сформулируйте правила Клечковского. Какие энергетические подуровни характеризуются одинаковыми значениями суммы n + l, равными 3, 4, 5, 6 и 7? 12. Напишите формулы электронных конфигураций атомов элементов F, Ne, P, Ca, Co, La, Ru, W, Po, U, Bk, Md. Для каждого из элементов изобразите электронно-графические схемы двух последних энергетических уровней их атомов. 13. Что является главной характеристикой атома? 14. Дайте современную формулировку периодического закона и поясните его физический смысл. 15. Каковы основные формы изображения таблицы периодической системы элементов? Укажите их сходства и различия. 16. Каков физический смысл номера периода, номера группы в таблице периодической системы? Покажите на примерах. 17. Что такое s -, p -, d -, f -элементы? Каково их расположение по периодам и группам в таблице периодической системы? Каковы максимальные емкости периодов? 18. В чем проявляется сходство и различие элементов групп «А» и «В» (главных и побочных подгрупп)? Поясните понятие «элементы-аналоги». 19. Каковы факторы, определяющие характер изменения химических свойств атомов элементов и соответствующих простых веществ по периодам и группам? 20. Объясните суть понятий: эффективный, ковалентный, ионный, ван-дер-Ваальсовский, металлический, орбитальный радиусы. В чем их сходство и различие? 21. Какие радиусы отвечают по смыслу понятию «атомный радиус»? Поясните, как влияют на величину атомного радиуса следующие факторы: эффективный заряд ядра, конфигурация внешнего электронного слоя, число электронных слоев, тип химической связи и ее кратность. 22. Что такое потенциал ионизации и энергия ионизации атома? Чем они отличаются и как связаны между собой? От каких факторов зависит его величина? 23. Проанализируйте изменение первой энергии ионизации атомов элементов второго периода по мере увеличения Z. 24. Дайте определение понятия «сродство к электрону». 25. Какие факторы определяют величину сродства к электрону? Как можно объяснить различные знаки этой характеристики для атомов разных элементов? 26. Могут ли существовать в свободном состоянии анионы O2ˉ, S2ˉ, N3ˉ? Почему? 27. Что такое электроотрицательность? Какую способность атома она характеризует? 28. Каковы принципы построения шкалы электроотрицательности элементов? Как изменяется эта характеристика по периодам и группам периодической системы по мере увеличения Z?
1.8. ХИМИЧЕСКАЯ СВЯЗЬ
Вопросы для самостоятельной подготовки
1. Что такое химическая связь? Укажите условия и причины ее образования. 2. Какова природа химической связи? 3. Каковы основные типы химической связи? Укажите сходство и различия между ними. 4. Дайте определение ковалентной связи. Какова схема ее образования (на примере молекул H2, Cl2 и HCl)? 5. Назовите и проиллюстрируйте конкретными примерами основные механизмы образования ковалентной связи. 6. Сформулируйте основные положения метода валентных связей. 7. Перечислите основные свойства ковалентной связи и поясните их суть. 8. Перечислите виды ковалентной связи. Объясните механизм образования s-, p- и d- связей. 9. Что такое кратность связи? Каково ее влияние на длину и энергиию связи между атомами? 10. Что такое валентность? Чем она определяется? 11. Каковы условия образования полярной и неполярной ковалентной связи? Поясните понятие «эффективный заряд атома» на конкретных примерах. 12. Что такое электрический диполь? В каком соотношении находятся длина диполя и длина связи в двухатомной молекуле? 13. Что является мерой полярности связи? 14. Проанализируйте в сравнительном плане полярность молекул CO2 и SO2; NH3 и NF3; H2O и H2S. 15. Что такое стереохимия? 16. Чем определяется геометрическая форма молекул с ковалентным типом связей? 17. Дайте объяснение концепции гибридизации атомных орбиталей. 18. Поясните основные условия устойчивой гибридизации орбиталей. 19. Каковы основные типы гибридизации орбиталей? Какие геометрические формы частиц им соответствуют? 20. Что такое связывающие и несвязывающие орбитали? Каково их влияние на геометрическую форму частиц с ковалентными связями? 21. Как влияет природа лиганда и кратность связи на геометрическую форму однотипных частиц? 22. Что такое координационное число атомной частицы? Какова его количественная интерпретация? 23. Приведите примеры частиц с многоцентровыми (делокализованными) связями. 24. Чему равна валентность и степень окисления атомов азота и углерода в молекулах: N2, NH3, N2H4, NH2OH, NF3, CH4, CCl4, C2H6, C2H4, C2H2, CO2, CO? 25. Проанализируйте следующие молекулярные частицы (установите характер распределения валентных электронов, тип гибридизации орбиталей центральных атомов, валентные углы, полярность частиц, валентность и степень окисления отдельных атомов): CO, CO2, N2O, NO2, N2O5, HNO3, H2SO4, BF, BF3, NH3, NF3, 26. Дайте определение ионной связи. Какова ее природа и механизм образования? 27. Что такое степень ионности связи? 28. Перечислите и объясните основные характеристики ионной связи. Укажите, в чем ее сходство и различие с ковалентной полярной связью? 29. Чем определяется величина координационного числа ионов в ионных соединениях? 30. Какая связь в каждом из соединений – HClO, NaHSO4, KOH, H2CO3 – характеризуется наибольшей степенью ионности? 31. Дайте определение металлической связи. Какова ее природа и механизм образования? 32. Перечислите типы межмолекулярного взаимодействия. В чем заключаются их особенности? 33. Рассмотрите механизм образования водородной связи, ее отличие от химической связи и сил межмолекулярного взаимодействия. 34. Как влияет наличие водородной связи между молекулами или внутри молекул на физические и химические свойства веществ? Поясните на примере изменения свойств веществ в рядах HF – HI; H2O – H2Te; NH3 – SbH3; CH4 – SnH4. 35. Поясните роль водородной связи в биологических объектах на примере воды, белков, полисахаридов, ДНК, РНК.
1.9. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ К окислительно-восстановительным относятся реакции, протекающие с изменением степеней окисления атомных частиц (а. ч.), входящих в состав реагирующих веществ. Степень окисления – условный заряд а. ч., рассчитанный исходя из допущения, что вещество состоит из ионов. Поскольку такое допущение является условным, понятие «степень окисления» носит также условный характер и является величиной формальной, не отражающей реального распределения зарядов между атомами. Однако это понятие широко используется при составлении уравнений окислительно-восстановительных реакций (ОВР). Cтепени окисления а. ч. принимают значения от –4 до +8 в соответствии с правилами: 1. Степень окисления а. ч. в простых веществах равна 0, например, 2. А. ч. водорода в большинстве своих соединений находятся в степени окисления, равной +1. Однако в соединениях со щелочными и щелочноземельными металлами они проявляют степень окисления, равную –1, например: 3. А. ч. кислорода в подавляющем большинстве соединений находятся в степени окисления, равной –2, например: 4. А. ч. фтора в соединениях всегда проявляют только одну степень окисления, равную –1. 5. А. ч. элементов группы I-A (щелочные металлы) в соединениях всегда проявляют степень окисления, равную +1. 6. А. ч. элементов группы II-A (Be, Mg, щелочноземельные металлы), а также Zn и Cd в соединениях всегда проявляют степень окисления, равную +2. 7. А. ч. алюминия в соединениях находятся в степени окисления +3. Степени окисления а. ч. других элементов могут иметь переменные значения и рассчитываются исходя из того, что сумма степеней окисления всех а. ч. в молекуле или формульной единице равна 0, а в ионе – его заряду. Пример 1.9.1. Рассчитайте степень окисления а. ч. фосфора в ортофосфате кальция Са3(РО4)2. Pешение. Обозначим искомую степень окисления а. ч. фосфора через х. Учитывая число атомов каждого элемента в формульной единице и значения степеней их окисления, составим уравнение: 3 · (+2) + 2 · х + 8 · (–2) = 0, откуда х = + 5. В ходе любой ОВР одновременно протекают 2 процесса – окисление и восстановление. С точки зрения электронной теории окисление – процесс отдачи электронов, в ходе которого степень окисления атома повышается, а восстановление – процесс присоединения электронов, в ходе которого степень окисления атома понижается. А. ч., которые в ходе ОВР отдают электроны, называются восстановителями, как и вещества, в состав которых они входят. А. ч., присоединяющие электроны, называются окислителями, как и вещества, содержащие эти частицы. Таким образом, в ходе ОВРвосстановитель, отдавая электроны, восстанавливает, но сам окисляется; окислитель, принимая электроны, окисляет, но сам восстанавливается. При этом общее число электронов, отданных а. ч.-восстановителями, всегда равно числу электронов, принятых а. ч.-окислителями. Окислительно-восстановительные свойства веществ можно определить, исходя из значений степеней окисления а. ч., входящих в их состав: 1. Если в состав вещества входят а. ч. элемента в минимальной степени окисления, то оно может проявлять только восстановительные свойства. 2. Если в состав вещества входят а. ч. элемента в максимальной степени окисления, то оно может проявлять только окислительные свойства. 3. Если в состав вещества входят а. ч. элемента в промежуточной степени окисления, то оно может проявлять как восстановительные, так и окислительные свойства. Важнейшие восстановители 1. Простые вещества – все металлы и некоторые неметаллы, например Н2, С, Si, P4 и др. 2. Водородные соединения щелочных и щелочноземельных металлов, а также водородные соединения некоторых неметаллов, например: HI, HBr, H2O2, H2S, H2Se, H2Te, NH3, PH3, AsH3, SbH3, SiH4, SnH4. 3. Оксиды элементов, атомы которых находятся в промежуточной степени окисления. Это оксиды ряда неметаллов – СО, SO2, NO, P2O3, а также низшие оксиды некоторых р- и d -элементов – SnO, FeO, СrO, VO и соответствующие им соли, например SnCl2, FeSO4 и др. 4. Некоторые кислородсодержащие кислоты и их соли, в состав которых входят атомы элементов в промежуточных степенях окисления, например H2SO3, H3PO2, H3PO3, и их соли, а также тиосульфаты (Na2S2O3), дисульфиты (Na2S2O5), дитиониты (Na2S2O4), нитриты. 5. Некоторые органические вещества, например спирты, альдегиды, некоторые карбоновые кислоты (H─COOH, HOOC─COOH), углеводы (С6H12O6). Важнейшие окислители: 1. Простые вещества – галогены, озон, кислород, сера. 2. Оксиды некоторых р - и d -элементов в высоких степенях окисления, например Cl2O7, ClO2, I2O5, SO3, SeO3, SeO2, N2O5, NO2, PbO2, Mn2O7, MnO2, CrO3, V2O5. 3. Кислородсодержащие кислоты некоторых р - и d -элементов в высоких степенях окисления, например HClO3, H5IO6, HIO3, HBrO4, HBrO3, H2SO4, H2SeO4, H2SeO3, HNO3, H2CrO4, H2Cr2O7, HMnO4, и соли этих кислот. К окислителям относятся также кислородсодержащие кислоты галогенов, в которых они проявляют и более низкие степени окисления, например HClO, HClO2, а также их соли; 4. Пероксид водорода Н2О2, пероксиды щелочных и щелочноземельных металлов (Na2O2, BaO2). Ниже приведена классификация окислительно-восстановительных реакций. ОВР межмолекулярного типа Если а. ч.-восстановители и а. ч.-окислители содержатся в разных веществах, то ОВР относится к реакциям межмолекулярного типа. Например, в реакции
а. ч.-окислители ( Когда в ОВР межмолекулярного типа окислителями и восстановителями являются а. ч. одного и того же элемента, такие ОВР относятся к реакциям конпропорционирования или конмутации. Например, в реакции
окислителями и восстановителями являются а. ч. одного элемента – азота. Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал восстановления используемого окислителя больше потенциала окисления используемого восстановителя. Пример 1.9.5. Определите, можно ли использовать в стандартных условиях соли железа(III) для окисления ионов F–, Br– и I– до простых веществ? Ответ подтвердите расчетами. Решение. 1.Найдем значения Е о полуреакций:
2. Поскольку значение Любая ОВР всегда протекает в том направлении, которому соответствует положительное значение разности потенциалов окислителя и восстановителя. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при разности потенциалов Δ Е, большей либо равной 0,4 В. Если же разность потенциалов Δ Е оказывается меньше 0,4 В, то ОВР протекает обратимо и направление реакции определяется условиями ее проведения. Пример 1.9.6. Установить, в каком направлении возможно самопроизвольное протекание реакции SnCl4 + 2FeCl2 ↔ SnCl2 + 2FeCl3. Решение. 1.Находим значения Е о полуреакций:
2.Поскольку значение E о полуреакции с участием ионов железа больше значения Е о полуреакции с участием ионов олова, то ионы Fe3+ будут окислять ионы Sn2+ с образованием ионов Fe2+ и Sn4+. Это соответствует протеканию указанной реакции справа налево. Если числа молекул разных газов одинаковы, то при одних и тех же внешних условиях эти газы занимают одинаковые объемы. Экспериментально установлено, что любой газ химическим количеством 1 моль, содержащий 6,02∙1023 молекул, при нормальных условиях (н. у.) – температуре 0 оС или 273 K, и давлении 101,325 кПа – занимает объем, равный 22,4 дм3. Этот объем, отнесенный к количеству газа, равному 1 моль, называется молярным объемом газа при н. у. и обозначается символом
Следует помнить, что существует также понятие «молярный объем смеси газов». Эта величина обозначается Понятию «молярный объем газовой смеси» соответствует понятие «средняя молярная масса газовой смеси». Эта величина обозначается Физический смысл средней молярной массы газовой смеси: она численно равна массе смеси, в которой общее химическое количество газов равно 1 моль. Средняя молярная масса газовой смеси связана с молярными массами образующих ее газов соотношением Здесь φ(X) и φ(Y) – объемные доли газов в смеси, М (X) и M (Y) – молярные массы газов. Объемная доля газа (φ) в смеси – величина, равная отношению объема газа Х к объему смеси:
Как и массовая доля, она может выражаться в долях единицы или в процентах. Поскольку в воздухе φ(О2) ≈ 0,21, а φ(N2) ≈ 0,78, то средняя молярная масса воздуха ≈ 29 г/моль. Следует помнить, что объемные доли (φ) газов в смеси численно равны их мольным долям (χ):
2. Плотность газа – ρ – величина, численно равная отношению его молярной массы к молярному объему при н. у.: ρ(X)= Единицы плотности газов – г/дм3, кг/м3 и т. п. Например, плотность кислорода при н. у. равна: ρ(O2) = Физический смысл плотности газа в том, что она численно равна массе газа объемом 1 дм3 (н. у.). Существует также понятие «плотность газовой смеси». Эта величина обозначается ρ(см.) и рассчитывается по формуле
Например, плотность воздуха при н. у. равна:
3. Относительная плотность газа Х по газу Y (
Относительная плотность одного газа по другому – величина безразмерная. Физический смысл относительной плотности газа X по газу Y: она показывает, во сколько раз масса газа X при одних и тех же условиях больше массы газа Y, если их химические количества одинаковы:
Наиболее часто при решении задач используются значения относительных плотностей газов по водороду и по воздуху, которые рассчитываются по формулам:
|
||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 751; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.89.50 (0.011 с.) |

 :
: (газ. см.) и численно равна отношению массы данной смеси к сумме химических количеств всех находящихся в ней газов:
(газ. см.) и численно равна отношению массы данной смеси к сумме химических количеств всех находящихся в ней газов: .
. (газ. см.) = φ(Х) · М (Х) + φ(Y) · M (Y).
(газ. см.) = φ(Х) · М (Х) + φ(Y) · M (Y). .
.
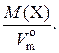


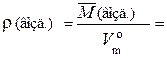
 = 1,295 г/дм3.
= 1,295 г/дм3. ) – величина, численно равная отношению молярных масс этих газов:
) – величина, численно равная отношению молярных масс этих газов: 
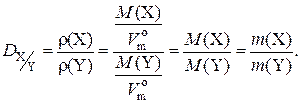
 и
и 

 .
.
 в растворе могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–, определите среду водного раствора гидросульфита натрия. Ответ подтвердите соответствующими расчетами.
в растворе могут диссоциировать, отщепляя ионы H+, и гидролизоваться, образуя ионы OH–, определите среду водного раствора гидросульфита натрия. Ответ подтвердите соответствующими расчетами. ,
,  ,
,  , HN3, SO2, SO42-, NO3-, NH4+, BF4-.
, HN3, SO2, SO42-, NO3-, NH4+, BF4-.

 ,
,  . В пероксидах они проявляют степень окисления, равную –1, например:
. В пероксидах они проявляют степень окисления, равную –1, например:  ,
,  . Положительные степени окисления а. ч. кислорода проявляют лишь в соединениях с фтором, например
. Положительные степени окисления а. ч. кислорода проявляют лишь в соединениях с фтором, например  .
.
 ) и а. ч.-восстановители (
) и а. ч.-восстановители ( ) находятся в разных веществах.
) находятся в разных веществах.
 = 0,53 В;
= 0,53 В;  = 1,08 В;
= 1,08 В;  2,85 В;
2,85 В; 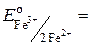 0,77 В.
0,77 В. больше значения
больше значения  , то ионы Fe3+ способны окислить ионы I– до простого вещества I2. Следовательно, из указанных анионов только ионы I– будут окисляться ионами железа(III).
, то ионы Fe3+ способны окислить ионы I– до простого вещества I2. Следовательно, из указанных анионов только ионы I– будут окисляться ионами железа(III). = – 0,15 В,
= – 0,15 В,  = 0,77 В.
= 0,77 В.


