
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Молекулярная физика и термодинамика.
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА. Статистический и термодинамический методы исследования. Термодинамическая система. Температура. Статистический метод: оперирует среднестатистические параметры, характеризующие частицы. Термодинамический метод: система тел, обменивающихся энергией друг с другом. Термодинамическая система: совокупность макроскопических тел, которые взаимодействуют и обмениваются энергией как между собой, так и между другими телами (внешней средой). Температура – физическая величина, характеризующая состояние термодинамического равновесия макроскопической системы. В международной практической шкале температура замерзания и температура кипения воды при давлениии 105Па соответственно 0 и 100 град цельстя. Идеальный газ. Законы Бойля-Мариотта, Авогадро, Дальтона, Гей-Люссака. Идеальный газ – это когда: 1) сумма объема молекул намного меньше объема сосуда, в котором находятся молекулы. 2) столкновение молекул м/у собой и со стенками сосуда упруго-идеальное. 3) взаимодействие молекул на расстоянии нет.
Авогадро: 1 моль любого газа при одинаковых температуре и давлении занимает одинаковый объем. При н.у. v=22.4*10-3 м3/моль NА=6.02*1023 моль-1 Дальтона: давление смеси идеальных газов равно сумме парциальных давлений p1,p2,…pn, входящих в нее газов: p=p1+p2+…pn Парциальное давление – давление, которое производил бы газ, входящий в состав газовой смеси, если бы он один занимал объем, равный объему смеси той же температуры.
Уравнение состояния идеального газа. Уравнение Менделеева-Клапейрона. Уравнение состояния, которое в общем виде:
pV=RT – уравнение состояние идеального газа, которое так же называется уравнением Менделеева-Клапейрона. R=8.31 Дж/(моль*К) Уравнение для m газа: pV=
Основное уравнение молекулярно кинетической теории. Средняя квадратичная скорость молекул.
Учитывая, что Где Е – суммарная кинетическая энергия поступательного движения всех молекул газа. Т.к. m=Nm0, то PV=RT, RT=
Закон Максвелла о распределения молекул идеального газа по скоростям. Скорости, характеризующие состояние вещества. В газе, находящемся в состоянии равновесия, устанавливается некоторое стационарное, не меняющееся со временем распределения молекул по скоростям состояние, которое подчиняется вполне определенному статистическому закону Максвелла
Наиболее вероятная скорость - скорость, при которой функция распределения молекул идеального газа по скоростям максимальна. Средняя скорость: Средняя квадратичная: Барометрическая формула. Распределение Больцмана.
Она позволяет найти атмосферное давление в зависимости от высоты или измерив давление, найти высоту.
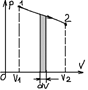
Если частицы имеют одинаковую массу и находятся в состоянии хаотичного теплового движения, то распределение Больцмана справедливо в любом внешнем потенциальном поле, а не только в поле сил тяжести. Работа при расширении газа. Полную работу А, своершаемую газом при изменении его объема от V1 до V2:
Теплоемкость твердых тел. Молярная теплоемкость твердого тела: Т.е. молярная(атомная теплоемкость химически простых тел в кристаллическом состоянии одинакова(равна 3R) и не зависит от температуры. Это закон Дюлонга и Пти. Молярная теплоемкость твердых химических соединений:
МОЛЕКУЛЯРНАЯ ФИЗИКА И ТЕРМОДИНАМИКА.
|
||||||||||||||
|
Последнее изменение этой страницы: 2016-08-10; просмотров: 118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.49.90 (0.008 с.) |




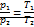


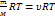




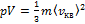
 =>
=> 
 =
= 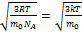 -средняя квадратичная скорость.
-средняя квадратичная скорость.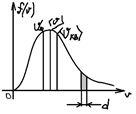
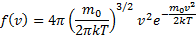


 =1,22
=1,22 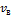
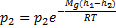 –Барометрическая формула.
–Барометрическая формула. распределение Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия молекул.
распределение Больцмана для внешнего потенциального поля. Из него следует, что при постоянной температуре плотность газа больше там, где меньше потенциальная энергия молекул.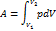

 =
=  3 R = 25,12 Дж/моль·К.
3 R = 25,12 Дж/моль·К.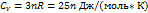 Т.е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.
Т.е. равна сумме атомных теплоемкостей элементов, составляющих это соединение.


