Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Координационные числа некоторых основных комплексообразователейСодержание книги
Поиск на нашем сайте
Важнейшей количественной характеристикой любого лиганда является его дентатность. Она представляет собой число атомов из одной частицы-лиганда, которые непосредственно связаны с комплексообразователем. Дентатность лигандов-молекул NH3, H2O и CO равна 1. Если лигандами являются анионы, то очень часто их дентатность равна абсолютному значению их заряда (хотя может быть и меньше). В любой комплексной частице координационное число комплексообразователя равно сумме дентатностей всех лигандов. Заряд внешней сферы КС всегда равен по абсолютному значению, но противоположен по знаку заряду внутренней сферы, который, в свою очередь, равен алгебраической сумме зарядов центрального атома и лигандов. Пример 1.10.1. Рассмотрим строение ряда комплексных соединений:
Классификация комплексных соединений В зависимости от знака заряда внутренней сферы различают: 1) Анионные КС, например K[Zn(H2O)(CN)3], где внутренняя сфера [Zn(H2O)(CN)3]– – анион. 2) Катионные КС, например [Cu(NH3)4]SO4, в которых внутренняя сфера [Cu(NH3)4]2+ – катион. 3) Катионно-анионные КС, например [Cu(NH3)4][Zn(CN)4], состоят из двух внутренних сфер, одна из которых – катион, а другая – анион. 4) Нейтральные КС, например [Pt(NH3)2Cl2]0 не имеют внешней сферы. Особую группу составляют хелатные (клешневидные) комплексные соединения, в которых атомы комплексообразователей и атомы лигандов образуют циклические группировки, состоящие чаще всего из 5 или 6 атомов. К таким соединениям относятся, например, внутрикомплексные соединения. Внутрикомплексные соединения – хелатные соединения, в которых каждый лиганд связан с комплексообразователем двумя ковалентными связями, одна из которых образована по обменному, а другая – по донорно-акцепторному механизму. Такие соединения широко распространены в живой природе. Важнейшими из них являются, например, гем крови и хлорофилл. В зависимости от природы лигандов комплексные соединения делят на следующие основные типы: 1) Ацидокомплексы (от лат. acidum – кислота), в которых лиганды – кислотные остатки, например K4[Fе(СN)6], Na3[Ag(S2O3)2]. 2) Гидроксокомплексы, в которых лиганды – гидроксид-анионы, например K[Au(OH)4], Na3[Al(OH)6]. 3) Aквакомплексы (от лат. aqua – вода) или гидраты, в которых лиганды – молекулы воды, например, [Сr(Н2О)6]Сl3, [Cu(H2O)6](ClO4)2. 4) Aмминкомплексы или аммиакаты, в которых лиганды – молекулы аммиака, например [Cu(NH3)4]SO4, [Pt(NH3)6]Cl4. Номенклатура комплексных соединений Названия комплексообразователей В названиях катионных КС применяется русскоязычное наименование комплексообразователя в родительном падеже, например Сu2+ –меди(II), Fe3+ – железа(III). Наименования анионных КС состоят из корня латинского названия комплексообразователя и русскоязычного суффикса «ат», например Сu2+ – купр ат (II), Fe3+ –ферр ат (III). В случае нейтральных КС используют русское название комплексообразователя в именительном падеже, например, Сu2+ –медь(II), Fe3+ – железо(III).
Названия лигандов Названия нейтральных лигандов:Н2О – «аква», NH3 – «аммин», СО – «карбонил», NO – «нитрозил», N2H4 – «гидразин». Названия лигандов-анионов. Если латинское название аниона заканчивается суффиксом «ид», его заменяют на букву «о»: F– – фтор о, СN– –циан о, S2– – ти о, OH– – гидрокс о и т. д. Исключение: Н– – гидр идо. Если латинское название аниона заканчивается суффиксом «ат» или «ит», то к нему добавляется буква «о»: Для обозначения числа одинаковых лигандов во внутренней сфере комплекса в качестве приставок перед их названиями используют греческие числительные: ди; три; тетра; пента; гекса и т. д. Приставку моно не употребляют. Название внутренней сферы записывают в одно слово.
Названия комплексных соединений Порядок названия комплексных соединений аналогичен порядку названий обычных солей, т. е. сначала указывается анион в именительном падеже, а затем катион в родительном падеже. Формулы комплексов читаются строго справа налево с соблюдением указанного в них порядка расположения лигандов. Пример 1.10.2. Приведите примеры координационных соединений различных типов и назовите их. Решение. Катионные КС: [Co(NH3)6]3+Cl3 – хлорид гексаамминкобальта(III); [Cr(NH3)5H2O]3+(NO3)3 – нитрат аквапентаамминхрома(III). Анионные КС: (NH4)2[PdCl4]2- – тетрахлоропалладат(II) аммония; K[Pt(NH3)Br5]– – пентабромoамминплатинат(IV) калия; K4[Fe(CN)6]4– – гексацианоферрат(II) калия. Нейтральные КС: [Fe(H2O)3Cl(NCS)2] – дитиоцианохлоротриакважелезо(III); [Pt(NH3)2Cl2] – дихлородиамминплатина(II); [Hg(H2O)2(CN)2] – дицианодиаквартуть(II). Катионно-анионные КС: [Cu(NH3)4][Zn(H2O)(CN)3]2 – трицианоаквацинкат тетраамминмеди(II); Диссоциация комплексных соединений в водных растворах Различают первичную и вторичную диссоциацию КС в растворах. Первичная диссоциация заключается в том, что катионные и анионные КС необратимо распадаются на ионы внешней и внутренней сфер, например: [Ag(NH3)2]+Cl → [Ag(NH3)2]+ + Cl–; K4[Fe(CN)6] → 4K+ + [Fe(CN)6]4–. КС катионно-анионного типа при этом также необратимо распадаются на комплексные катионы и комплексные анионы; [Cu(NH3)4][Zn(H2O)(CN)3]2 → [Cu(NH3)4]2+ + 2[Zn(H2O)(CN)3]–. Вторичной диссоциации подвергаются комплексные частицы (внутренние сферы). Они обратимо и постадийно диссоциируют на составные части. Например, при вторичной диссоциации комплексный анион [Ag(NH3)2]+ обратимо и по стадиям отщепляет частицы лигандов – молекулы NH3. Поскольку в растворе при этом устанавливаются динамические равновесия, каждой стадии вторичной диссоциации соответствует своя константа равновесия. Она называется константой нестойкости (K нест) комплексного иона по данной стадии:
1-я стадия: [Ag(NH3)2]+ ↔ [Ag(NH3)]+ + NH3;
2-я стадия: [Ag(NH3)]+ ↔ Ag+ + NH3;
При этом всегда K 1 нест > K 2 нест. Но поскольку они отличаются не очень сильно, часто используют общую константу нестойкости комплексного иона K нест. Она является константой равновесия суммарного процесса вторичной диссоциации: [Ag(NH3)2]+ ↔ Ag+ + 2NH3;
Для каждого комплексного иона при данной температуре K нест – постоянная величина (приложение 4). Чем меньше ее значение, тем устойчивее комплексный ион в растворе, тем слабее протекает его вторичная диссоциация и наоборот. Величина, обратная общей константе нестойкости комплексного иона, называтся общей константой его устойчивости K уст:
Соответственно чем больше K уст комплексного иона, тем он устойчивее в растворе и наоборот. Константы нестойкости комплексных ионов слабо зависят от температуры. Пример 1.10.3. Напишите координационную формулу сульфата гексаамминкобальта(III). Укажите заряд и координационное число комплексообразователя, заряд внутренней сферы. Напишите уравнения первичной и вторичной диссоциации и выражение константы нестойкости комплексного иона. Решение. 1) Сульфат гексаамминкобальта(III) – катионное КС состава [Co(NН3)6]2(SO4)3. Комплексообразователь – Со3+. Его координационное число в соответствии с правилом Вернера равно удвоенному значению заряда, т. е. 6. Лиганды – однодентатные молекулы аммиака. Заряд внутренней сферы, равный сумме заряда комплексообразователя и общего заряда всех лигандов, составляет 3+. 2) Уравнение первичной диссоциации КС (по типу сильного электролита): [Co(NН3)6]2(SO4)3 → 2[Co(NН3)6]3+ + 3 SO42–. 3) Общее уравнение вторичной диссоциации комплексного иона (по типу слабого электролита): [Co(NН3)6]3+ ↔ Со3+ + 6 NН3. 5) Выражение общей константы нестойкости комплексного иона:
Реакции с участием комплексных ионов Реакции ионного обмена К таким реакциям относятся, например, многочисленные реакции обмена КС с обычными солями. При этом КС обмениваются с ними своими составными частями – внешней или внутренней сферами, например: 3Cu2+SO4 + 2K3[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 3K2SO4; 3Cu2+ + 3 SO42– + 6K+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓ + 6K+ +3SO42–; 3Cu2+ + 2[Fe(CN)6]3– → Cu32+[Fe(CN)6]23–↓. Такие реакции протекают необратимо, если приводят к образованию малорастворимых продуктов.
Реакции лигандного обмена В ходе таких реакций лиганды в комплексных ионах замещаются другими лигандами – молекулами или ионами веществ, с которыми реагируют КС. Так, например, при добавлении аммиака в водный раствор сульфата никеля (II), содержащий комплексные акваионы [Ni(H2O)6]2+, молекулы аммиака обратимо вытесняют из них молекулы воды. Это приводит к образованию новых комплексных ионов: [Ni(H2O)6]2+ + 6NH3 ↔ [Ni(NH3)6]2+ +6H2O. Равновесия таких процессов всегда смещены в сторону более устойчивых комплексных ионов с меньшими значениями K нест. Например, K нест([Ni(H2O)6]2+) = 2,2 · 10–2, а K нест([Ni(H2O)6]2+) = 1,86 · 10–9.
Реакции связывания лигандов Они заключаются в том, что лиганды из комплексного иона связываются с молекулами или ионами добавляемого вещества, в результате чего комплексный ион разрушается. Так, например, при добавлении азотной кислоты к раствору комплексного соединения [Ag(NH3)2]Cl выпадает осадок AgCl. Это происходит потому, что ионы H+ из раствора кислоты соединяются с молекулами NH3 из комплексных ионов [Ag(NH3)2]+ , образуя катионы серебра и катионы аммония: [Ag(NH3)2]+ + 2H+ → Ag+ + 2NH4+.
Реакции осаждения комплексообразователей Их суть состоит в том, что при добавлении к раствору КС специальных реагентов, содержащиеся в них ионы соединяются с ионами комплексообразователя, образуя малорастворимые вещества. Так, например, при добавлении раствора KI к раствору хлорида диамминсеребра [Ag(NH3)2]Cl выпадает осадок AgI, вследствие чего комплексные ионы разрушаются: [Ag(NH3)2]Cl + KI → AgI↓ + KCl + 2 NH3. Это происходит потому, что ионы I– образуют с ионами Ag+ чрезвычайно мало растворимый иодид серебра. Пример 1.10.4. К раствору, в котором молярные концентрации [Ag(NH3)2]NO3 и аммиака равны соответственно 0,1 моль/дм3 и 10 моль/ дм3, добавили раствор хлорида калия такого же объема с молярной концентрацией KCl, равной 0,1 моль/дм3. Образовался ли при этом осадок AgCl? Решение. 1.Рассчитаем молярную концентрацию ионов [Ag(NH3)2]+ и аммиака в растворе после добавления равного объема раствора KCl. Поскольку объем исходного раствора увеличился в 2 раза, то молярная концентрация всех содержавшихся в нем веществ уменьшилась в 2 раза и составляет для [Ag(NH3)2]+ и NH3 соответственно 0,05 моль/дм3 и 5 моль/дм3. 2.Рассчитаем молярную концентрацию ионов Ag+ в полученном растворе. Допустим, что концентрация распавшихся комплексных ионов равна х моль/дм3. Согласно уравнению диссоциации [Ag(NH3)2]+ концентрации образовавшихся Ag+ и NH3 равны соответственно х моль/дм3 и 2 х моль/дм3. Тогда концентрация оставшихся ионов [Ag(NH3)2]+ будет составлять (0,05 – х) моль/дм3, а концентрация аммиака – (5 + 2 х) моль/дм3. Поскольку значение х очень мало, им можно пренебречь и считать, что равновесные концентрации [Ag(NH3)2]+ и NH3 в растворе равны их исходным концентрациям, т. е. соответственно 0,05 моль/дм3 и 5 моль/дм3: [Ag(NH3)2]+ ↔ Ag+ + 2NH3 0,05 моль/дм3 х моль/дм35 моль/дм3 3.Значения концентраций частиц подставим в выражение константы нестойкости комплексного иона: 4. 5.Рассчитаем значение ПК ионов Ag+ и Cl– в растворе после смешивания: Поскольку были смешаны растворы равных объемов, концентрация ионов Cl– после смешивания также уменьшилась в 2 раза и составила 0,05 моль/дм3. Тогда получаем: ПК = с (Ag+) · c (Cl–) = 1,86 ·10–10 · 0,05 = 9,31·10–12. 6.Поскольку значение ПК меньше значения ПР(AgCl), равного
Пример 1.10.5. Будет ли разрушаться комплексный ион [Ag(NH3)2]+ в условиях примера 10.4 при замене KCl на KI? Решение. Поскольку все расчеты остаются прежними, нужно только сравнить найденное значение ПК ионов Ag+ и I– с справочным значением ПР(AgI), равным 1·10–16. Так как 9,31 · 10–12 >1·10–16, то осадок AgI выпадает и, следовательно, комплексный ион [Ag(NH3)2]+ в тех же условиях ионами Iˉ разрушается.
Реакции полного восстановления В ходе таких реакций комплексообразователь восстанавливается до простого вещества и выделяется из раствора в виде металлического осадка. Так, например, при добавлении цинка в раствор дицианоаурата(I) калия выделяется чистое золото: Zn0 + 2K[Au+(CN)2] → Au0↓ + K2[ Эта реакция длительное время использовалась для промышленного получения золота по методу Багратиона. Химическая связь в комплексных соединениях. Между ионами внешней и внутренней координационных сфер осуществляется ионная связь. Внутри комплексных частиц центральные атомы связаны с лигандами ковалентными связями, образованными по обменному и по донорно-акцепторному механизмам. Для наглядного объяснения образования химической связи в комплексных частицах и их геометрической формы удобно использовать метод валентных связей (МВС). Согласно этому методу химические связи между атомами комплексообразователей и лигандами образуются по донорно-акцепторному механизму, а геометрическая форма комплексных частиц определяется типом гибридизации орбиталей центральных атомов (табл. 4). Таблица 4 Важнейшие типы гибридизации орбиталей и соответствующие им
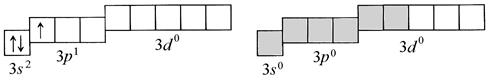
Используя МВС, рассмотрим образование химических связей в комплексном катионе гексаакваалюминия [А1(Н2О)6]3+ и его геометрическую форму. В этой комплексной частице роль комплексообразователя играет катион алюминия A13+, образующийся в результате отщепления от атома алюминия трех электронов: Al0 – 3
Al0: 1 s 22 s 22 p 6 3 s 23 p 13 d 0;Al+3: 1 s 22 s 22 p 6 3 s 03 p 03 d 0
Рис. 1. Схемы распределения валентных орбиталей в атоме и в катионе алюминия
В катионе А13+ имеются 6 вакантных орбиталей (выделены серым цветом): одна – на 3 s -, три – на 3 р- и две на 3 d -подуровне. Они отличаются друг от друга своей пространственной формой и энергией. Из этих шести различных орбиталей образуются шесть совершенно одинаковых по форме и энергии гибридных орбиталей (sp 3 d 2-гибридизация). Они располагаются в пространстве октаэдрически и перекрываются с орбиталями неподеленных электронных пар шести молекул воды. При этом молекулы Н2О являются донорами неподеленных электронных пар, а катион A13+ – их акцептором. Так по донорно-акцепторному механизму образуются 6 ковалентных связей Н2О→Al в катионе гексаакваалюминия. Они, как и гибридные орбитали катиона А13+, имеют октаэдрическую направленность. Поэтому комплексный катион [А1(Н2О)6]3+ представляет собой октаэдр (восьмигранник), в центре которого расположен комплексообразователь – катион алюминия, а в вершинах находятся лиганды – молекулы воды (рис. 2).
Вопросы для самостоятельной подготовки
1. Сформулируйте основные положения координационной теории 2. Какие частицы выступают в роли комплексообразователей? Перечислите наиболее типичные из них. Что характеризует координационное число комплексообразователя? От каких факторов оно зависит? 3. Чем объясняется особая склонность атомов и катионов d -элементов выступать в качестве комплексообразователей? 4. Какие частицы выступают в роли лигандов? Приведите примеры электронейтральных и заряженных лигандов. Чему равна их дентатность и что она характеризует? Приведите примеры моно-, би-, три- и тетрадентатных лигандов. 5. Какие лиганды называются хелатирующими? Приведите примеры. 6. Может ли молекула метана быть лигандом? Ответ поясните. 7. Как классифицируются комплексные соединения в зависимости от заряда комплексной частицы? Приведите примеры. 8. Как можно рассчитать заряд комплексной частицы; комплексообразователя; внешней координационной сферы? Приведите примеры. 9. Назовите комплексные соединения: K[Cu(NH3)(CN)3]; [Cu(NH3)3Cl]2CO3; [Cu(NH3)(H2O)(С2О4)]. Определите тип каждого КС; заряд комплексообразователя и его КЧ; дентатность лигандов. 10. Напишите уравнения первичной и вторичной диссоциации следующих КС: тетратиоцианодиамминхромат(III) аммония; карбонат нитратотриамминмеди(II); дицианодиамминпалладий(II). Приведите выражения общих констант нестойкости соответствующих комплексных частиц. 11. Каков тип химической связи между внешней и внутренней координационными сферами КС? 12. Каков тип химической связи между центральным атомом и лигандами? 13. Как происходит образование комплексных частиц согласно МВС? 14. На основе МВС объясните образование и геометрическую форму комплексных частиц: катиона тетраакважелеза(II); гексафтороалюминат-аниона; тетракарбонилникеля(0). 15. Какие типы изомерии присущи комплексным соединениям? Приведите примеры. 16. В чем заключается различие между комплексными соединениями и двойными солями? 17. При отравлениях соединениями Hg, Pb, Cu, Ag, Cd, Be в качестве противоядий из подручных средств принимают яичный белок или молоко. На чем основано их использование в данном случае? 18. В каких случаях в медицине используются хелатирующие лиганды, в том числе и трилон-Б? На чем основано их применение? 19. Что представляет собой гем крови? Почему гемоглобин способен взаимодействовать как с кислородом, так и с угарным газом? Задачи и упражнения 312. Составьте максимально возможное число формул комплексных частиц (катионных, анионных, нейтральных), в состав которых могут входить: а) комплексообразователи – Cr+3 (KЧ = 6); Pb+2 (KЧ = 4); Ag+ (KЧ = 2); б) лиганды – NH3, H2O, CN–, CO32–, PO43–. Определите заряды комплексных частиц. 313. Составьте формулы всех комплексных соединений, в состав которых могут входить следующие ионы: NH4+, [BeF4]2–, [Fe(CN)6]3–, [Cr(H2O)5CN]2+, [Cu(NH3)4]2+. Для каждого из указанных комплексных ионов определите заряд комплексообразователя и его координационное число. 314. Напишите координационные формулы следующих комплексных соединений: нитрат карбонатоакватриамминкобальта(III); дибромотетрацианоплатинат(IV) калия; сульфатотиоцианотриаквахром(III). Чему равны координационные числа комплексообразователей и дентатность лигандов в этих соединениях? Напишите уравнения электролитической диссоциации комплексных соединений и соответствующие выражения общих констант нестойкости комплексных частиц. 315. Из раствора КС условного состава PtCl4 · 6NH3 нитрат серебра осаждает весь хлор в виде хлорида серебра, а из раствора соли PtCl4 · 3NH3 – только 1/4 часть входящего в ее состав хлора. Напишите координационные формулы и назовите эти КС. Укажите координационное число платины в каждом из них. Как диссоциироуют эти КС в растворе? 316. У двух КС кобальта одинаковая эмпирическая формула – CoBrSO4 · 5NH3. Одна из них в растворе реагирует только с хлоридом бария, а другая – только с раствором нитрата серебра, образуя в обоих случаях осадки. Напишите координационные формулы этих КС и назовите их. Приведите выражения констант нестойкости соответствующих комплексных ионов. 317. К раствору, содержащему КС условного состава CoCl3 · 4NH3 массой 0,2335 г, добавили в достаточном количестве раствор AgNO3. Масса образовавшегося при этом осадка составила 0,1435 г. Определите координационную формулу КС и назовите его. Напишите уравнения его первичной и вторичной диссоциации и выражение общей константы нестойкости комплексного иона. 318. Напишите в молекулярной и ионно-молекулярной формах уравнения обменных реакций между: а) K4[Fe(CN)6] и CuSO4; б)Na3[Co(CN)6] и FeSO4; в) K3[Fe(CN)6] и AgNO3, имея в виду, что образующиеся КС нерастворимы в воде. Приведите их названия. 319. Напишите уравнения реакций образования комплексных кислот и оснований при взаимодействии: PtCl2 и HCl; AgCl и HCl; PbCl2 и HCl; AlF3 и HF; Pd(CN)2 и HCN; BF3 и HF; Cu(OH)2 и NH3; Ni(OH)2 и NH3. (Координационные числа комплексообразователей определите по правилу Вернера.) Приведите уравнения первичной и вторичной диссоциации полученных соединений. 320. Напишите координационные формулы следующих комплексных соединений: а) гексанитрокобальтат(III) калия; б) амминнитротетрахлорокобальтат(III) аммония; в) трифторогидроксобериллат галлия(III); г) тетратиоцианодиамминхромат(III) аммония. Укажите для каждого КС координационное число комплексообразователя и заряд внутренней сферы. 321. Назовите КС: [Pd(NH3)3Cl]Cl; K4[Fe(CN)6]; [Pt(NH3)(H2O)2Cl]OH; [Co(NH3)4(H2O)CN]Br2; [Cr(NH3)5SO4]NO3; (NH4)2[Rh(NH3)Cl5]; Na2[PbI4]; [Cu(NН3)4](NO3)2; K2[Co(NH3)2(NO2)4]. Напишите выражения общих констант нестойкости комплексных ионов, укажите координационные числа комплексообразователей. 322. Как объяснить, что комплексный катион [Ag(NH3)2]+ разрушается уже при слабом подкислении раствора, а катион [Pt(NH3)4]2+ сохраняется даже при действии концентрированных кислот? 323. Объясните: а) почему осадок AgCl не растворяется в соляной кислоте, но растворяется в растворе аммиака?; б) почему осадок AgI не растворяется в растворе аммиака, но растворяется в иодоводородной кислоте? 324. Чем определяется возможность замены одних лигандов в комплексных частицах на другие? Определите направление реакций в растворах: а) [Ag(CN)2]ˉ + 2NO2ˉ ↔ [Ag(NO2)2]ˉ + 2CNˉ; б) [Ag(NO2)2]ˉ + 2NH3 ↔ [Ag(NH3)2]+ + 2NO2ˉ; в) K2[HgCl4] + 4KI ↔ K2[HgI4] + 4KCl? 325. Рассчитайте молярную концентрацию ионов комплексообразователей в водных растворах КС, концентрации которых составляют: а) гидроксид диамминмеди(I) – 0,3 моль/дм3; б) дитиосульфатоаргентат(I) натрия – 0,2 моль/дм3. 326. В раствор объемом 0,5 дм3 с молярной концентрацией [Ag(NH3)2]NO3, равной 0,1 моль/дм3, пропустили аммиак объемом 11,2 дм3 (н. у.), который полностью растворился. Определить, как и во сколько раз при этом изменилась концентрация ионов серебра в растворе? 327. Равновесные концентрации ионов Ag+ и молекул NH3 в аммиачном растворе нитрата диамминсеребра равны соответственно 3 · 10–4 моль/дм3 и 5 · 10–3 моль/дм3. Определите концентрацию КС в этом растворе. 328. Концентрация ионов Сu2+ растворе H2[CuCl4], содержащем HCl, равна 2,5 · 10–2 моль/дм3, а концентрация ионов С1– составляет 1 · 10–1 моль/дм3. Рассчитайте концентрацию комплексных ионов в указанном растворе. 329. Какие комплексные ионы образуются при растворении амфотерных гидроксидов цинка и алюминия в растворах кислот и в растворах щелочей? 330. Допишите уравнения: а) [Cr(H2O)6]3+ + 3OH– → б) [Cr(H2O)6]3+ + OH– (изб) → в) [Cr(OН)6]3– + 3H3О+ → г) [Cr(OН)6]3– + H3О+(изб) →. 331. Допишите приведенные ниже уравнения реакций. Укажите, к какому типу относится каждая из них и чем определяется направление ее протекания: а) K2[CuCl4] + NH3 → б) Na3[Ag(S2O3)2] + Na2S → в) Fe3+ + [Fe(CN)6]4– → г) [Co(NO2)6]3– + K+ → д) Cu(OH)2 + Na2SO3 → [Cu(SO3)4]6– +? 332. Напишите уравнения реакций, соответствующих превращениям: Ag+ → [Ag(NH3)2]+ → AgI →Na3[Ag(S2O3)2] → [Ag(CN)2]ˉ → Ag2S. Как объяснить возможность осуществления каждого из них?
2. НЕОРГАНИЧЕСКАЯ ХИМИЯ
2.1. Примерная схема описания группы
1. Общие сведения о химических элементах (положение в таблице периодической системы, открытие, содержание в земной коре, основные природные соединения). 2. Электронные конфигурации атомов в основном и в возбужденном энергетических состояниях. 3. Закономерности изменения атомных характеристик элементов по группам (относительная атомная масса, ковалентный, металлический и ионный радиусы, энергия ионизации, сродство к электрону, электроотрицательность, степени окисления). 4. Важнейшие физико-химические свойства простых веществ (аллотропные (полиморфные) модификации, их агрегатное состояние, цвет, плотность, температуры плавления и кипения, электропроводность). 5. Способы получения простых веществ (лабораторные и промышленные). 6. Химические свойства простых веществ: а) реакции с простыми веществами (водородом, галогенами, кислородом, серой, азотом, фосфором, углеродом, кремнием, металлами); б) реакции с важнейшими реагентами – сложными веществами (водой, основными и кислотными оксидами, кислотами, основаниями, солями). 7. Строение, химические свойства и получение основных типов соединений. а) Бинарные соединения: · соединения с водородом; · галогениды; · оксиды; · соединения с другими неметаллами; · соединения с металлами. б) Многоэлементные соединения: · гидроксиды (кислотные, основные, амфотерные); · соли; · комплексные соединения. 8. Взаимосвязь между основными типами соединений. 9. Применение: а) простых веществ; б) соединений. 10. Биологическая роль простых веществ и соединений элементов в процессах жизнедеятельности человека и животных. Применение в медицине.
2.2. р - ЭЛЕМЕНТЫ VII ГРУППЫ Вопросы для самостоятельной подготовки 1.Как изменяются в ряду галогенов по мере увеличения их атомных номеров радиусы атомов, энергии ионизации, сродство к электрону, электроотрицательность атомов, энергия химической связи в молекулах и их термическая устойчивость? 2. Какие степени окисления проявляют а. ч. галогенов в соединениях? Каковы особенности валентных состояний фтора? 3. Запишите уравнения реакций, отражающих промышленные и лабораторные способы получения галогенов. 4. Охарактеризуйте окислительно-восстановительные свойства простых веществ галогенов и сформулируйте соответствующие закономерности. Напишите уравнения соответствующих реакций. 5. Напишите уравнения реакций, использующихся для получения галогеноводородов в промышленности и в лабораторной практике. Каковы особенности этих процессов? 6. Как изменяются физические свойства, полярность и прочность молекул в ряду HF – HI? 7. Проанализируйте и объясните характер изменения окислительно-восстановительных и кислотных свойств в ряду галогеноводородов. 8. Напишите уравнения реакций взаимодействия галогенов с водой и растворами щелочей (холодными и горячими). 9. Напишите уравнения реакций разложения хлорноватистой кислоты под действием света; при нагревании; в присутствии водоотнимающего вещества? 10. Напишите уравнения реакций, использующихся для получения хлоратов и перхлоратов в промышленности и в лаборатории. 11. Какие галогены и в каких условиях вытесняют бром из бромида калия; бромата калия? Ответ обоснуйте, используя данные о стандартных электродных потенциалах. Напишите уравнения соответствующих реакций. 12. Как и почему изменяются кислотные и окислительные свойства в рядах: 13. Что такое хлорная известь; жавелевая вода? Где они находят применение? Напишите уравнения реакций их получения? 14. Сравните гидролизуемость солей и объясните характер ее изменения в рядах: а) KClO – KClO2 – KClO3 – KClO4; б) KClO – KBrO – KIO? 15. Можно ли получить оксиды галогенов взаимодействием соответствующих простых веществ? Напишите уравнения реакций, использующихся для получения важнейших оксидов хлора. 16. Какова геометрическая форма ионов ClO–, ClO2–, ClO3–, ClO4–? 17. Какие соединения хлора, фтора, брома и иода применяются в медицине? 18. Неизвестный галогеноводород пропустили в раствор щелочи массой 100 г с массовой долей КОН 11,2 %. В образовавшемся нейтральном растворе массовая доля соли оказалась равной 13,89 %. Определите галогеноводород. 19. Рассчитайте объем хлора (н. у.) и объем раствора гидроксида калия с его массовой долей 50 % и плотностью 1,538 г/мл, необходимых для получения бертолетовой соли массой 250 г, если ее выход равен 88 %. 20. Напишите уравнения реакций, при помощи которых можно осуществить превращения: а) PbBr2 ® HBr ® Br2 ® KBrO3 ® HBrO3® FeBr3; б) Cl2 ® HCl ® KCl ® Cl2 ® BaCl2 ® HCl; в) Cl2 ® KClO3 ® KClO4 ® HClO4 ® ClO2 ® HClO3. 21. Напишите уравнения следующих реакций: а) K2Cr2O7 + HCl (конц) б) KI + H2SO4 (конц) ® в) HBrO3 + I2 ® г) I2 + HNO3 (конц) д) HClO3 + HCl ® е) K2Cr2O7 + KI + H2SO4 (разб) ® ж) I2 + H2S (р-р) ® з) KI + H2O2 + H2SO4 ® и) Cl2 + I2 + Ba(OH)2 ® к) Cl2 + KI + KOH ® л) HClO4 + P2O5 ® м) CaOCl2 + HCl ® н) HCl + PbO2 ® о) Br2 + F2 + H2O ® п) HClO3 + P + H2O ® 2.3. p - ЭЛЕМЕНТЫ VI ГРУППЫ.
Вопросы для самостоятельной подготовки 1. Рассмотрите строение и валентные состояния атомов элементов группы VI-А. 2. Как изменяются радиусы, энергии ионизации, сродство к электрону и электроотрицательность атомов в ряду кислород – полоний? Как это можно объяснить? 3. Как и почему изменяется агрегатное состояние и состав простых веществ в ряду O – Po? Какие аллотропные модификации образуют элементы этой группы? 4. Каков характер изменения окислительно-восстановительных свойств простых веществ в ряду кислород – полоний? Ответ подтвердите уравнениями соответствующих химических реакций. 5. Как изменяются
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 8335; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.226.169.169 (0.011 с.) |

 – сульфат о,
– сульфат о,  – сульфит о,
– сульфит о,  – нитрат о и т. д. Исключение:
– нитрат о и т. д. Исключение: 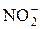 – нитр о (без суффикса «ит»).
– нитр о (без суффикса «ит»).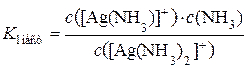 ;
; .
. = K 1 нест · K 2 нест.
= K 1 нест · K 2 нест.

 . Отсюда х = 1,86 ·10–10 моль/дм3.
. Отсюда х = 1,86 ·10–10 моль/дм3.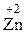 (CN)4].
(CN)4]. → Al+3 (рис. 1).
→ Al+3 (рис. 1).