
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
ОВР внутримолекулярного типаСодержание книги
Поиск на нашем сайте
Если а. ч.-восстановители и а. ч.-окислители содержатся в одном и том же исходном веществе, то ОВР относится к реакциям внутримолекулярного типа, например:
В данной реакции а. ч.-окислители ( Когда в реакциях внутримолекулярного типа окислителями и восстановителями являются а. ч. одного и того же элемента, такие ОВР относятся к реакциям диспропорционирования или дисмутации. Например, в реакции
окислителями и восстановителями являются а. ч. одного элемента – хлора. Расстановка коэффициентов в уравнениях ОВР Обратите внимание: в уравнениях ОВР межмолекулярного типа расстановка коэффициентов проводится слева направо (пример 9.2), а в уравнениях ОВР внутримолекулярного типа – справа налево (пример 9.3). Пример 1.9.2. Расставьте коэффициенты методом электронного баланса в уравнении ОВР: H2 Решение. 1.Определим, у а. ч. каких элементов и как изменились степени окисления? В данном случае это – кислород и хром. А. ч. кислорода изменили степень окисления от –1 до 0, а хрома – от +6 до +3. 2.Определим тип ОВР и направление расстановки коэффициентов. Поскольку а. ч. 3.Запишем электронные уравнения процессов окисления и восстановления, найдем наименьшее общее кратное чисел отданных и принятых электронов и составим схему электронного баланса:
4.Найдем числа а. ч., изменивших степени окисления. Для этого каждое из уравнений электронного баланса умножим на соответствующий множитель (первое уравнение – на 3, второе – на 1). Получим: число а. ч. кислорода, изменивших степень окисления, равно 2 · 3 = 6, а число а. ч. хрома равно 2 · 1 = 2. 5.Расставим коэффициенты перед формулами веществ. а) уравняем числа а. ч. хрома, поставив перед формулами K2Cr2O7 и Cr2(SO4)3 коэффициенты 1; б) уравняем числа а. ч. кислорода, изменивших степень окисления, поставив перед формулами O2 и H2O2 коэффициенты 3. в) уравняем числа а. ч. калия, поставив перед формулой K2SO4 коэффициент 1; г) уравняем числа кислотных остатков д) уравняем числа атомов водорода, поставив перед формулой воды коэффициент 7; 6.Проверим, одинаковы ли числа а. ч. кислорода в левой и правой частях уравнения: 3H2O2 + K2Cr2O7 + 4H2SO4 = 3O2 + Cr2(SO4)3 + K2SO4 + 7H2O. Пример 1.9.3. Методом электронного баланса расставьте коэффициенты в уравнении реакции:
Решение. 1.Определим степени окисления а. ч. до и после реакции и найдем элементы, у а. ч. которых изменились степени окисления. В данном случае это – азот и кислород. А. ч. азота изменили степень окисления от +5 до +4, а кислорода – от –2 до 0. 2.Определим тип ОВР и направление расстановки коэффициентов. Поскольку а. ч. 3.Запишем электронные уравнения процессов окисления и восстановления, найдем наименьшее общее кратное чисел отданных и принятых электронов и составляем схему электронного баланса:
4.Найдем числа а. ч., изменивших степени окисления. Для этого каждое из уравнений электронного баланса умножим на соответствующий множитель (первое уравнение – на 1, второе – на 4). Получим, что число а. ч. кислорода, изменивших степень окисления, равно 2 · 1 = 2, а соответствующее число а. ч. азота равно 1 · 4 = 4. Но поскольку в формульной единице Fe(NO3)3 содержится 3 а. ч. азота, перед данной формулой придется поставить дробный коэффициент 4/3, что не совсем удобно. Поэтому для избавления от дробного коэффициента найденные числа а. ч. азота и кислорода умножим на 3. Получается, что степени окисления изменились у 6 а. ч. кислорода и у 12 а. ч. азота. 5.Расставим коэффициенты перед формулами веществ. а) уравняем числа а. ч. азота, поставив перед формулой NO2 коэффициент 12, а перед формулой Fe(NO3)3 – коэффициент 4; б) уравняем числа а. ч. кислорода, изменивших степень окисления, поставив перед формулой O2 коэффициент 3; в) уравняем числа а. ч. железа, поставив перед формулой Fe2O3 коэффициент 2. 6.Проверим, одинаковы ли числа атомов кислорода в левой и правой частях уравнения: 4Fe(NO3)3 = 2Fe2O3 + 12NO2 + 3O2. Электродные и окислительно-восстановительные Количественной характеристикой окислительно-восстанови-тельных свойств веществ в водных растворах являются значения электродных или окислительно-восстановительных потенциалов соответствующих полуреакций. Электродный потенциал представляет собой разность потенциалов, возникающую на границе раздела электрод – раствор электролита. Абсолютные значения потенциалов экспериментально определить невозможно, поэтому на практике используются их относительные значения, измеренные по отношению к стандартному водородному электроду, потенциал которого условно приравнивается к 0. Потенциалы, измеренные в стандартных условиях (концентрации ионов равны 1 моль/дм3, давление водорода равно 101,325 кПа, температура составляет 25 оС), называются стандартными электродными или стандартными окислительно-восстановительными потенциалами и обозначаются символом Е о. Их значения используются для характеристики реакций, протекающих в стандартных условиях. Если же реакция протекает в других условиях, то для ее описания используются равновесные потенциалы Е, которые рассчитываются по уравнению Нернста:
где 2,303 – коэффициент перехода от натуральных логарифмов к десятичным; R – молярная газовая постоянная; T – абсолютная температура; n – число электронов, принимающих участие в полуреакции; F – постоянная Фарадея, равная примерно 96500 Кл/моль; с восст (Х) – концентрация восстановленной формы элемента Х, в которой его а. ч. находятся в более низкой степени окисления; с окисл (Х) – концентрация окисленной формы элемента Х, в которой его а. ч. находятся в более высокой степени окисления. Если в уравнение Нернста подставить числовые значения
Из уравнения Нернста следует, что величина потенциала зависит от концентраций восстановленной и окисленной форм элемента. Если в реакции принимает участие металл, то величина его электродного потенциала зависит лишь от концентрации ионов этого металла (его окисленной формы) в растворе. Концентрация самого металла (восстановленной формы), как величина постоянная, в уравнение Нернста не подставляется. Кроме того, если в полуреакции принимают участие ионы H+ или ОН–, их концентрации также влияют на величину потенциала. Используя значения электродных или окислительно-восстановительных потенциалов полуреакций, можно выполнить следующие операции: 1. Оценить окислительно-восстановительные свойства соответствующих веществ. 2. Предсказать принципиальную возможность осуществления реакции в указанном направлении. 3. Определить направление протекания реакции. 4. Выбрать наиболее вероятную реакцию из нескольких возможных. 5. Рассчитать значение константы химического равновесия данной реакции. Сформулируем соответствующие правила и рассмотрим их применение на конкретных примерах. Более сильными восстановительными свойствами обладает вещество, которому соответствует полуреакция с более низким значением потенциала. Более сильными окислительными свойствами обладает вещество, которому соответствует полуреакция с более высоким значением потенциала. Пример 1.9.4. Определите, какой из восстановителей проявляет наиболее сильные восстановительные свойства при стандартных условиях в реакциях: а) FeSO4 + O2 + H2SO4 → Fe2(SO4)3 + H2O; б) HI + O2 → I2 + H2O; в) H2SO3 + O2 → H2SO4. Решение. 1. Определим, какие вещества в данных реакциях являются восстановителями. В реакции а) восстановителем является FeSO4 , поскольку у железа степень окисления повышается от +2 до +3 в соответствии с уравнением полуреакции
В реакции б) восстановителем является HI, поскольку у иода степень окисления повышается в соответствии с уравнением полуреакции
В реакции в) восстановителем является H2SO3, поскольку у серы степень окисления увеличивается в соответствии с уравнением полуреакции H2SO3 + H2O – 2ē → H2SO4 + 4H+. 2. Найдем значения стандартных потенциалов cоответствующих полуреакций: а) 3.Определим наиболее сильный восстановитель. Поскольку самое низкое значение потенциала у полуреакции окисления сернистой кислоты, то это вещество и будет являться наиболее сильным восстановителем. Протекание окислительно-восстановительной реакции в данном направлении возможно лишь тогда, когда потенциал восстановления используемого окислителя больше потенциала окисления используемого восстановителя. Пример 1.9.5. Определите, можно ли использовать в стандартных условиях соли железа(III) для окисления ионов F–, Br– и I– до простых веществ? Ответ подтвердите расчетами. Решение. 1.Найдем значения Е о полуреакций:
2. Поскольку значение Любая ОВР всегда протекает в том направлении, которому соответствует положительное значение разности потенциалов окислителя и восстановителя. Однако необходимо помнить, что в данном направлении реакция протекает практически необратимо при разности потенциалов Δ Е, большей либо равной 0,4 В. Если же разность потенциалов Δ Е оказывается меньше 0,4 В, то ОВР протекает обратимо и направление реакции определяется условиями ее проведения. Пример 1.9.6. Установить, в каком направлении возможно самопроизвольное протекание реакции SnCl4 + 2FeCl2 ↔ SnCl2 + 2FeCl3. Решение. 1.Находим значения Е о полуреакций:
2.Поскольку значение E о полуреакции с участием ионов железа больше значения Е о полуреакции с участием ионов олова, то ионы Fe3+ будут окислять ионы Sn2+ с образованием ионов Fe2+ и Sn4+. Это соответствует протеканию указанной реакции справа налево.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2016-06-23; просмотров: 619; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.237.52 (0.011 с.) |


 ) и а. ч.-восстановители (
) и а. ч.-восстановители ( ) содержатся в одном веществе.
) содержатся в одном веществе.
 2 + K2
2 + K2  2 +
2 +  2(SO4)3 + K2SO4 + H2O.
2(SO4)3 + K2SO4 + H2O. , изменившие степени окисления, содержатся в разных веществах, то данная ОВР относится к реакциям межмолекулярного типа. В таком случае расстановку коэффициентов проводим «слева направо». Это значит, что в электронных уравнениях число атомных частиц равно их числу в формулах соответствующих исходных веществ.
, изменившие степени окисления, содержатся в разных веществах, то данная ОВР относится к реакциям межмолекулярного типа. В таком случае расстановку коэффициентов проводим «слева направо». Это значит, что в электронных уравнениях число атомных частиц равно их числу в формулах соответствующих исходных веществ.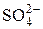 , поставив перед формулой серной кислоты коэффициент 4;
, поставив перед формулой серной кислоты коэффициент 4;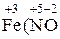 3)3 →
3)3 →  2O3 +
2O3 +  O2 +
O2 +  и
и  , изменившие степени окисления, содержатся в одном и том же веществе, данная ОВР относится к реакциям внутримолекулярного типа. В таком случае расстановку коэффициентов проводим «справа налево». Это значит, что в электронных уравнениях число атомных частиц равно их числу в формулах продуктов реакции.
, изменившие степени окисления, содержатся в одном и том же веществе, данная ОВР относится к реакциям внутримолекулярного типа. В таком случае расстановку коэффициентов проводим «справа налево». Это значит, что в электронных уравнениях число атомных частиц равно их числу в формулах продуктов реакции.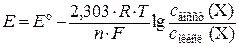
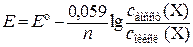 .
. – ē →
– ē →  – ē →
– ē →  .
. б)
б)  в)
в) 
 = 0,53 В;
= 0,53 В;  = 1,08 В;
= 1,08 В;  2,85 В;
2,85 В; 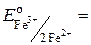 0,77 В.
0,77 В. больше значения
больше значения  , то ионы Fe3+ способны окислить ионы I– до простого вещества I2. Следовательно, из указанных анионов только ионы I– будут окисляться ионами железа(III).
, то ионы Fe3+ способны окислить ионы I– до простого вещества I2. Следовательно, из указанных анионов только ионы I– будут окисляться ионами железа(III). = – 0,15 В,
= – 0,15 В,  = 0,77 В.
= 0,77 В.


