
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ферменты, изоферменты, кинетика ферментативного катализа.Содержание книги
Поиск на нашем сайте
Ферменты- это биологические катализаторы белковой природы. Бóльшая часть биохимических реакций, катализируемых ферментами, идет сама по себе, но в отсутствие последних протекала бы крайне медленно. Многие клетки содержат до 1000 различных ферментов. Классификация ферментов: 6 классов ферментов: 1. оксидоредуктазы- катализируют окислительно-восстановительные реакции, в которых, как правило, участвуют два субстрата, S и S¢; 2.трансферазы- катализируют реакции переноса химических групп от субстрата-донора на субстрат-акцептор. Н-р, метилтрансфераза; аминотрансфераза; киназы- перенос остатка фосфорной кислоты (глюкокиназа); 3. гидролазы- катализируют гидролиз сложных соединений с присоединением по концам расщепляемой связи остатков воды (гликозидазы, эстеразами, пептидазы.); 4.лиазы- катализируют расщепление или образование химических соединений, при этом образуются или исчезают двойные(ферменты, катализирующие разрыв связи с выделением углекислого газа- декарбоксилазы, осуществляющие удаление воды- дегидратазы); 5. изомеразы - перемещают группы в пределах молекулы без изменение общей формулы субстрата (глюкозо-6-фосфатизомераза); 6.лигазы- катализируют реакции соединения более простых молекул в сложные, сопряженные с распадом АТР(аминоацил–т-РНКсинтетаза). Изоферменты. Физически различимые формы ферментов, обладающие одним и тем же видом каталитической активности, могут присутствовать в разных тканях одного организма, в разных типах клеток одной ткани и даже в одной клетке прокариотического организма, например, в E. Coli (дегидрогеназы, оксидазы, трансаминазы, фосфатазы). В различных тканях могут присутствовать разные изоферменты, и эти изоферменты могут иметь различное сродство к субстрату. Механизм действия ферментов. Размеры ферментов намного превышают размеры их низкомолекулярных субстратов. В катализе участвует небольшая область молекулы белка- каталитический центр. В работу многих ферментов включаются регуляторные (аллостерические) центры. Модели фермент-субстратного взаимодействия: Модель «ключ—замок», Модель индуцированного соответствия. Факторы, влияющие на активность ферментов. Температура. Для большинства ферментов оптимальной температурой является та температура, при которой в норме функционируют клетки. рН. Оптимальная активность обычно наблюдается в интервале рН 5,0-9,0. Вместе с тем отдельные ферменты активны при значениях рН, лежащих далеко за пределами этого интервала, например пепсин активен при рН 1,5-2,0. Концентрация реагентов. Скорость реакции пропорциональна концентрациям реагирующих молекул. скорость реакции ~ [А][В]. Концентрация фермента. Начальная скорость, будет прямо пропорциональна концентрации фермента. Уравнение Михаэлиса–Ментен. Важнейшим фактором, определяющим скорость ферментативной реакции, является концентрация реагирующих веществ, концентрация субстратов. Как было указано выше, фермент взаимодействует с субстратом. Затем фермент-субстратный комплекс распадается с образованием продукта реакции, а катализатор остается в первоначальном состоянии. Ниже приведено уравнение, отражающее процесс ферментативного катализа с образованием продукта реакции: Уравнение Михаэлиса-Ментен:
Графическое определение Км. Графически Км может быть представлена, как это показано на рисунке. Однако в случае многих ферментов определение V max и К m непосредственно из графика зависимости Vо от [S] (рисунок 1) оказывается затруднено. Для большего удобства уравнение Михаэлиса–Ментен было преобразовано Лайнуивером и Берком в координатах двойных обратных величин: Рисуно 1. Зависимость скорости ферментативной реакции от концентрации субстрата. Графическое представление Км.
. Рисунок 2. График Лайнуивера–Берка в двойных обратных координатах (зависимость 1/Vо от 1/[S]), используемый для графического определения Km и V max
. 39.Биохимические основы адаптации. Общие представления о биохимических механизмах адаптации живых организмов к среде Выделяют 3 типа адаптивных механизмов: 1. Приспособление макромолекулярных компонентов клеток или жидкостей организмов. Существует 2 типа такого приспособления: - изменение количества (концентрации) уже имеющихся типов макромолекул, например ферментов; - образование макромолекул новых типов, например, новых изоферментов, которыми заменяются ранее имевшиеся макромолекулы. 2. Приспособление микросреды, в которой функционируют макромолекулы. Например, изменяются осмотические свойства среды или состав растворенных веществ. 3. Приспособление на функциональном уровне. В данном случае изменение эффективности макромолекулярных систем, в особенности ферментов, не связано с изменением числа имеющихся в клетке макромолекул или их типов. В этом случае адаптацию обеспечивает изменение в использовании уже существующих макромолекулярных систем в соответствии с текущими локальными потребностями в той или иной активности. Это осуществляется на уровне метаболической регуляции за счет увеличения или уменьшения активности ферментов.
|
||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 425; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.129.194.30 (0.006 с.) |


 . Где где Кm – константа Михаэлиса, которая равна концентрации субстрата (выраженной в молях/литр), при которой скорость реакции составляет половину максимальной скорости. Константа Михаэлиса Кm, характеризует сродство фермента к субстрату.
. Где где Кm – константа Михаэлиса, которая равна концентрации субстрата (выраженной в молях/литр), при которой скорость реакции составляет половину максимальной скорости. Константа Михаэлиса Кm, характеризует сродство фермента к субстрату. , упростив выражение:
, упростив выражение: 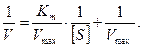 , это уравнение представляет собой уравнение прямой: у = ах + b, где у = 1/Vо и х = 1/[S]. В итоге:
, это уравнение представляет собой уравнение прямой: у = ах + b, где у = 1/Vо и х = 1/[S]. В итоге:  График уравнения Михаэлиса–Ментен в обратных координатах называют графиком Лайнуивера–Берка.
График уравнения Михаэлиса–Ментен в обратных координатах называют графиком Лайнуивера–Берка.



