
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Реакции окисления – восстановленияСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В химических системах окисление рассматривается как перенос электронов от молекулы - донора к молекуле – акцептору. Протоны могут высвобождаться в окружающий раствор или переноситься вместе с электронами на акцептор. Кислород электрофилен, поэтому в аэробных клетках он служит конечным акцептором электронов. В биологических системах между кислородом и окисляемым метаболитом расположены промежуточные акцепторы электронов. Первыми и важнейшими переносчиками электронов и протонов являются никотинамидадениндинуклеотид (НАД+) – производный витамина РР и флавинадениндинуклеотид (ФАД) – производный витамина В2. НАД+ принимает участие в ферментативных реакциях: будучи восстановленным, он покидает один фермент и переносится на другой, где и окисляется. ФАД, в отличие от НАД+, прочно связан с ферментом.
Все ферменты, катализирующие реакции биологического окисления, относятся к 1-ому классу ферментов - оксидоредуктазам. Окислительно-восстановительные ферменты подразделяются на четыре подкласса. 1. Дегидрогеназы - ферменты, катализирующие перенос атома водорода от субстрата к акцептору водорода. Дегидрогеназы - это кофакторзависимые ферменты. Кофакторы: пиридиновые (НАД+, НАДФ+) и флавиновые (ФАД, ФМН) переносчики водорода. 2. Оксидазы -- флавинзависимые ферменты, катализирующие перенос водорода от субстрата к молекуле кислорода, с образованием, в зависимости от специфичности, воды или пероксида водорода. Оксидазы - металлопротеиды. Эти ферментативные системы катализируют восстанавление кислорода. В активном центре этих оксидаз включены один или несколько атомов металла переменной валентности (Fe, Cu, Zn, Mn, Со, Мо). Эти металлы являются донорами электронов для кислорода. Одни оксидазы катализируют перенос одного электрона на кислород, другие - перенос 2-х или 4-х с образованием различных продуктов восстановления кислорода (супероксидрадикала, нитроксидрадикала, радикала коэнзима Q и др.) З. Оксигеназы – ферменты, катализирующие включение кислорода в субстрат. Монооксигеназы включают один атом кислорода в окисляемый субстрат, а другой в молекулу воды или пероксида водорода. Диоксигеназы вводят в субстрат оба атома кислорода.
4. Пероксидазы и каталазы – ферменты, катализирующие реакции, протекающие с участием пероксида водорода как окислителя. В качестве восстановленной формы образуется вода. Пути утилизации кислорода Кислород – сильный окислитель. Окислительно-восстановительный потенциал пары кислород/вода равен +0,82 в. Кислород обладает высоким сродством к электронам. Существует два пути утилизации кислорода в организме: оксидазный и оксигеназный.
Оксидазный путь Оксигеназный путь
полное неполное
конечный продукт моноокси- диокси- пероксидное
R-OH HO-R-OH R-O-O-H Оксидазный путь В основе оксидазного пути утилизации кислорода лежит реакция дегидрирования, в результате которой происходит отщепление 2-х атомов водорода (2Н↔2Н++2ē) от окисляемого субстрата с последующим переносом их на кислород. Для полного восстановления кислорода до воды требуется две пары электронов (4ē). Одномоментно к ½ О2 присоединяется 2 ē.
Для неполного восстановления кислорода до пероксида водорода требуется одна пара электронов (2 ē). Одномоментно присоединяется один электрон.
Оксигеназный путь В основе оксигеназного пути утилизации кислорода лежит непосредственное включение кислорода в окисляемый субстрат, с образованием соединений с одной или несколькими гидроксильными группами или органических соединений с пероксидной группой. Монооксигеназы – ферментативные системы, катализирующие включение в модифицируемый субстрат только один атом кислорода, а второй атом кислорода восстанавливается до воды в присутствии НАДФН+Н+ как источника водорода. RН2 + О2 + НАДФН+Н+ → R-OH + НАДФ+ + Н2О Диоксигеназы – ферментативные системы, катализирующие включение в субстрат двух атомов кислорода.
Общие пути метаболизма. Ацетил-КоАявляется центральным метаболитом превращения глюкозы, жирных кислот и некоторых аминокислот.
|
||||||||||||||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 690; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.216.95.31 (0.009 с.) |













 А НАДН+Н+ В А ФАДН2 В
А НАДН+Н+ В А ФАДН2 В
 Окисление
Окисление
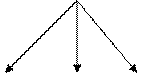



 Н2О Н2О2 путь путь
Н2О Н2О2 путь путь


 2ē ½О2 + 2ē ОН-
2ē ½О2 + 2ē ОН- RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О
RH2 + ½O2 R + H2O ОН- + 2Н+ ——► 2 Н2О
 2 Н+
2 Н+ О2 + Н+ НО•2 перекисный радикал
О2 + Н+ НО•2 перекисный радикал НО·2 + ē НО2- перекисный ион
НО·2 + ē НО2- перекисный ион НО-2 + Н+ Н2О2 пероксид водорода
НО-2 + Н+ Н2О2 пероксид водорода RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+
RH2 + 2О2 + НАДФН+Н+ НО-R-OH + НАДФ+


