Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление энергетических субстратовСодержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
В реакции дегидрирования при действии НАД+- и ФАД - зависимыхдегидрогеназ (ДГ)от энергетических субстратов отщепляются два атома водорода. Ферменты локализованы в матриксе митохондрий, за исключением ФАД-зависимой сукцинатдегидрогеназы, которая локализована на поверхности внутренней мембраны митохондрий.
Пиридинзависимые дегидрогеназы
β-гидроксиацил-КоА НАД+ НАДН+Н+ β-кетоацил-КоА Флавинзависимые дегидрогеназы
ФАД ФАДН2
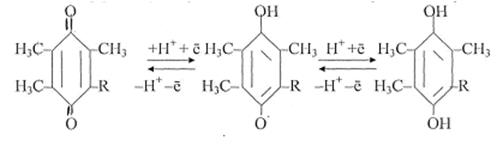
В восстановленных коферментах 2ē находятся на более высоком энергетическом уровне, это высокоэргические электроны. НАДН+Н+ ↔ 2Н ↔ 2Н+ + 2ē Таким образом, химическая энергия субстратов (АН2) трансформировалась в энергию электронов атомов водорода (электрическую энергию). Кофакторы дегидрогеназ (НАДН + Н+ - и ФАДН2 –зависимых) являются переносчиками двух атомов водорода на другую ферментативную систему, а именно – на систему дыхательной цепи. 2.Окисление НАДН+Н + и ФАДН2 в митохондриальной дыхательной цепи (ЦПЭ). Окисление НАДН+Н+ и ФАДН2 осуществляется при участии окислительно-восстановительных ферментов митохондрий по реакции НАДН+Н++ 1/2 O2 → НАД+ + H2O Изменение свободной энергии этого процесса составляет: ΔG° = -220 кДж/моль (ΔG° = - 52,6 ккал/моль). Сущность окисления заключается в последовательной передаче электронов от НАДН+Н+ и ФАДН2 на кислород при помощи специальных переносчиков в электронтранспортной цепи. Переносчики электронов в электронтранспортной цепи Окислительно-восстановительные переносчики локализованы на поверхности или встроены во внутренней мембране митохондрий. Мерой сродства окислительно- восстановительной пары к электронам служит окислительно-восстановительный потенциал Ео, величина которого определяет направленность переноса электронов. Типы переносчиков ФМН-содержащий переносчик электронов. По структуре ФМН представляет моно-нуклеотид, у которого в качестве азотистого основания служит изоаллоксазин, соединенный через рибозу с остатком фосфорной кислоты. При восстановлении он приобретает не только электроны, но и протоны. Ео = +0,12 ФМН + 2Н+ + 2ē ↔ ФМНН2 Железо-серные центры Это белковые негемовые железосодержащие переносчики электронов. Имеются несколько типов железо-серных центров: Fe-S,Fe2-S2, Fe4-S4. Атомы железа комплексов могут отдавать и принимать электроны, поочередно переходя в ферро-(Fe2+) - и ферри-(Fe3+) - состояния. Все железо-серные центры отдают электроны убихинону. Fe3+-S + 2ē ↔ Fe2+-S Убихинон, кофермент-Q(KoQ) – единственный небелковый переносчик электронов.
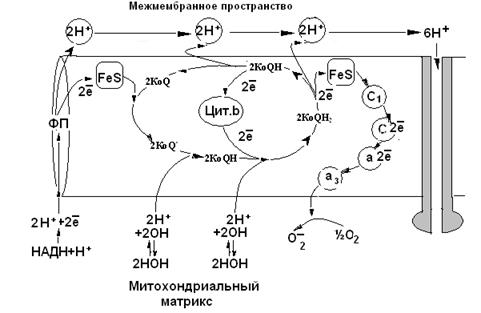
КоQ (хинон) КоQ (семихинон) КоQН2 (гидрохинон) Убихинон при восстановлении приобретает не только электроны, но и протоны. При одноэлектронном восстановлении он превращается в семихинон – органический свободный радикал. Ео=+0,01 Цитохромы – белковые переносчики электронов, в качестве простетической группы, содержащие гемовое железо. В основе функционирования цитохромов лежит изменение степени окисления атома железа Fe3+ +ē ↔ Fe2+. Различные цитохромы обозначаются буквенными индексами: b, с1, с, a, a3. Отличаются цитохромы по структуре белковой части и боковых цепей гема, в связи с этим они имеют и различные величины редокс-потенциалов (окислительно-восстановительных потенциалов). Цитохром «b» Ео = +0,08, «ci» Ео =+0,22, «с» Ео = +0,25, «ааз» Е о= +0,29. Отличительной особенностью цитохрома с является то,что он непрочно связан с внешней поверхностью внутренней мембраны митохондрий и легко покидает её. Все эти переносчики электронов можно сгруппировать в четыре ферментативных комплекса, структурированные во внутренней мембране митохондрий, представляющие собой ферментативный ансамбль,получивший название «дыхательные ферменты»,«цитохромная система», «ЦПЭ»(цепь переноса электронов). Комплекс I – НАДН-дегидрогеназа (НАДН-КоQ-редуктаза). Простетические группы -ФМН, FeS. Акцептор электронов – KoQ. Комплекс III – КоQН2-дегидрогеназа (KoQH2 -цит.с-редуктаза). Простетические группы: FeS, цитохромы b1, b2, с1. Акцептор электронов – цитохром - с. Комплекс IV – цитохромокcидаза. Простетические группы: цитохромы ааз, Си2+. Акцептор электронов– кислород. Комплекс II – сукцинатдегидрогеназа (Сукцинат-КоQ-редуктаза). Простетические группы ФАД, FeS. Акцептор электронов – KoQ. Между комплексами электроны транспортируются при помощи подвижных переносчиков - убихинона и цитохрома-с. Окислительно-восстановительные переносчики в ЦПЭ расположены в порядке увеличения стандартных окислительных потенциалов, что обеспечивает самопроизвольный транспорт двух электронов по дыхательной цепи от НАДН+Н+ к кислороду - конечному акцептору электронов. Перенос двух электронов по ЦПЭ является полезной работой и сопровождается поэтапным высвобождением свободной энергии Гиббса (ΔG), которая далее используется в синтезе АТФ.Поэтапное высвобождение энергии приводит к тому, что электроны, которые восстанавливают кислород, находятся на более низком энергетическом уровне, по сравнению с электронами, находящимися в восстановленном НАДН +Н+ в начале цепи. З. Генерирование протонного потенциала ΔμН+ Каким же образом осуществляется сопряжение транспорта электронов по дыхательной цепи с трансформацией высвободившейся электрической энергии в энергию химических связей АТФ? На этот вопрос в 1961 году дал ответ английский ученый Питер Митчелл. Его концепция заключалась в том, что движущей силой синтеза АТФ является электрохимический потенциал, протонный потенциал – ΔμH+. ΔμH+. = Δ рН+ Δ φ рН — градиент протонов, Δφ – разность электрического потенциала. В 1978 году П. Митчеллу была присуждена Нобелевская премия и хемиосмотическая теория стала общепризнанной. По теории П. Митчелла высвобождающаяся поэтапно энергия в процессе транспорта электронов по дыхательной цепи используется для выкачивания протонов из матрикса митохондрий в межмембранное пространство. Транспорт 2Н+ из матрикса митохондрий в межмембранное пространство создает градиент концентрации протонов - ΔрН и приводит к возникновению отрицательного заряда на поверхности мембраны со стороны матрикса и положительного заряда со стороны межмембранного пространства, при этом создается разность электрических потенциалов – Δφ. Источником протонов в матриксе митохондрий является НАДН + Н+, ФАДН2, вода. Возможность генерирования протонного потенциала обеспечивается: 1) непроницаемостью внутренней мембраны митохондрий для ионов вообще и, особенно, для протонов. 2) раздельным транспортом протонов и электронов по дыхательной цепи. Это обеспечивается наличием переносчиков 2-х типов: только для электронов и электронов и протонов одновременно. 4. Синтез АТФ за счет протонного потенциала Ферментативная система Н+ - АТФ- синтазный комплекс, АТФ-синтаза, АТФ-азакатализирует реакцию фосфорилирования АДФ неорганическимфосфатом за счет энергии которая аккумулирована в электрохимическом потенциале. Протонная АТФ-синтаза состоит из 2-х субкомплексов: F1 иFo. F1 - субъединица представлена 5 видами полипептидных цепей и отвечает за синтез и гидролиз АТФ. Имеет форму шляпки гриба, выступающего в матрикс митохондрий и связана с мембранной белковой субъединицей Fо. Fo - это гидрофобный сегмент из 4-х полипептидных цепей, который пронизывают всю мембрану митохондрий и образует протонный каналв ферментативном комплексе. Через протонные каналы АТФ-синтазы происходит, возвращение протонов обратно вматрикс митохондрий. Существует предположение,что прохождение протонов сопровождается конформационными изменениями активных центров АТФ-синтазы, что и стимулирует синтез АТФ. В соответствии с механизмом сопряжения окислительного фосфорилирования, предложенным Митчеллом, перенос двух протонов через, протонный канал АТФ-синтазы сопровождается синтезом одной молекулы АТФ. Реакции окисления, катализируемые пиридинзависимыми дегидрогеназами, сопряжены с I-м комплексом ЦПЭ,поэтому высвобождающаяся поэтапно энергия обеспечивает транслокацию в межмембранное пространство трех пар протонови следовательно, синтез 3-х молекул АТФ. Реакции окисления, катализируемые флавинзависимыми дегидрогеназами, сопряжены с III-м комплексом ЦПЭ и в межмембранное пространство переносятся лишь две пары протонов,следовательно, синтезируется 2 АТФ. Реакция окисления аскорбиновой кислотысопряжена на уровне семихинона,поэтому осуществляется транслокация только одной пары протонов и синтезируется лишь 1 молекула АТФ. Рис.6-2. Схема «Дыхательной цепи»
|
||||
|
Последнее изменение этой страницы: 2016-08-16; просмотров: 1785; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.97.1 (0.008 с.) |


 ПВК Ацетил - КоА
ПВК Ацетил - КоА






 Изоцитрат ДГ α-KT
Изоцитрат ДГ α-KT Малат ОАА
Малат ОАА
 Сукцинат ДГ Фумарат
Сукцинат ДГ Фумарат


 Ацил-КоА АН2 А Ациленоил -КоА
Ацил-КоА АН2 А Ациленоил -КоА