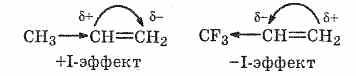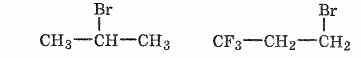Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Окисление кислородсодержащими окислителями и биологическое окислениеСодержание книги
Поиск на нашем сайте
Окисление кислородсодержащими окислителями и биологическое окисление. Алкены, в отличие от алка нов, легче подвергаются действию различных окислителей. В за висимости от условий образуются разные продукты. В жестких условиях окисление кислородом происходит по свободноради кальному механизму при значительной концентрации радика лов, в результате образуются СО 2 и Н 2 О: СН2= С Н 2 + 302 — ► 2С02 + 2Н20 В более мягких условиях окисление идет только по двойной свя зи. Окисление этена разбавленным раствором КМп0 4 в ней тральной или слабощелочной среде приводит к образованию двух атомного спирта - этиленгликоля (реакция Вагнера, 1888): ЗСН2==СН2 + 2КМп04 — ► ЗСН2— СН2 + 2Mn02 + 2К0Н ОН ОН В результате этой реакции раствор КМп0 4 обесцвечивается, поэтому она используется как качественная реакция на нали чие двойной связи в исследуемом веществе. При действии более сильных окислителей в жестких усло виях (кислотный раствор КМп0 4 или К 2 О 2 О 7, а также озон О 3 ) происходит окислительное расщепление молекулы алкена по двой ной связи с образованием соответствующих кислот:
При мягком окислении этилена кислородом в присутствии катализатора происходит образование оксида этилена. Это со единение содержит напряженный трехчленный цикл и поэтому, подобно циклопропану, легко вступает в реакции присоедине ния полярных реагентов Н 2 О, NHg, НС1:
Биологическое ферментативное окисление соединений с двойной межуглеродной связью довольно часто идет через ста дию ферментного окисного присоединения с образованием неус тойчивого оксида, который очень легко присоединяет воду или амины, трансформируясь в более устойчивые метаболиты:
Существует еще один путь ферментативного окисления ал кенов. Вначале идет ферментативное присоединение воды с по следующим ферментативным дегидрированием (окислением) по лученного продукта с образованием карбонилсодержащих мета болитов:
Этот путь имеет место при р-окислениижирных кислот в орга низме (разд.19.4.2). Наряду с ферментативным окислением алкены подвергают ся свободнорадикальному окислению. Окисление идет по угле родному атому, находящемуся рядом с двойной связью, по скольку при этом образуется энергетически выгодный аллиль ный радикал. Свободный аллильный радикал под действием кислорода и воды легко превращается в гидропероксид и сво бодный радикал НО-:
ООН I — ► R— СН—CH=CHR'+ НО* Гидропероксид Дальнейший путь окисления называют ав тоокислением, и он лежит в основе пероксидного окисления липидов, содержащих ненасыщенные жирные кислоты, с обра зованием из них карбоновых кислот с более короткой углеводо родной цепью (разд. 20.1). Автоокисление часто бывает причи ной порчи пищевых продуктов при хранении. За счет авто окисления на воздухе высыхают масляные краски, так как под действием кислорода происходит радикальная полимеризация их ненасыщенной масляной основы.
15. Химические свойства алкенов: реакции присоединения:
Галогенирование- Молекулы галогенов в среднем неполярны, однако возможны временные флуктуации, которые приводят к появлению электрофильности у такой молекулы:
Гидрирование- Взаимодействие алкенов с водородом происходит в присутствии металлических катализаторов (Ni, Pd, Pt и др.) при нагревании:
Гидрогалогенирование-
Гидратация-
16. Особенности строения и свойств сопряженных алкадиенов. Реакции присоединения, полимеризации.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 391; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.0.20 (0.005 с.) |