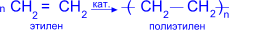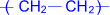Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Нуклеозидмоно- и полифосфаты. Амф, адф, атф. Их роль в биохимических процессах.Содержание книги
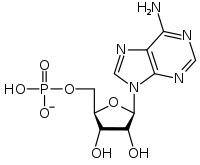
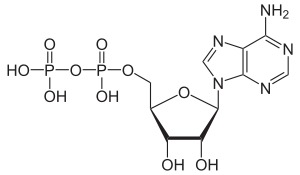
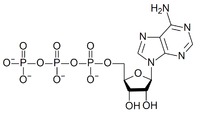
Поиск на нашем сайте Нуклеозидполифосфаты. Во всех тканях организма в свободном состоянии содержатся moho-, ди- и трифосфаты нуклеозидов. Особенно широко известны аденинсодержащие нуклеотиды — аденозин-5 -фосфат (АМР), аденозин-5 -дифосфат (ADP) и аде-нозин-5 -трифосфат (АТР) (для этих соединений, наряду с приведенными сокращенными обозначениями латинскими буквами, в отечественной литературе используют сокращения соответствующих русских названий — АМФ, АДФ, АТФ). В ряде биохимических реакций участвуют такие нуклеотиды, как гуанозинтрифос-ват (GTP), уридинтрифосфат (UTP), цитидинтрифосфат (СТР). Их дифосфатные формы обозначаются соответственно GDP, UDP н СОР. Нуклеозйддифосфаты и нуклеозидтрифосфаты часто объединяют термином нуклеозидполифосфаты. Все фосфорилированные нуклеозиды включаются в группу нуклеотидов,точнее,мононуклеотидов. Значение мононуклеотидов исключительно велико. Во-первых, мононуклеотиды, особенно нуклеозидполифосфаты, являются коэнзи-мами многих биохимических реакций они участвуют в биосинтезе белков, углеводов, жиров и других веществ. Большая роль их связана с наличием запаса энергии, аккумулированной в их полифосфатных связях. Известно также, что по крайней мере некоторые нуклеозидполифосфаты в ничтожных концентрациях оказывают действие на сложные функции, например деятельность сердца. Во-вторых, мононуклеотиды являются структурными компонентами нуклеиновых кислот— высокомолекулярных соединений, определяющих синтез белков и передачу наследственных признаков (они изучаются в биохимии) АМФ Аденозинмонофосфат
Аденозиндифосфат (АДФ)
Аденозинтрифосфа́т (сокр. АТФ, англ. АТР)
играют важнейшую роль в обмене веществ и энергий, т. к. присоединение фосфатных групп к АМФ сопровождается аккумуляцией энергии (АДФ, АТФ - макроэргические соединения), а их отщепление - выделением энергии, используемой для различных процессов жизнедеятельности (см. Биоэнергетика). В клетках постоянно происходят взаимопревращения АТФ, АДФ и АМФ.
12. Протонная теория кислот и оснований И. Бренстеда и Т. Лоури. Согласно теории Бренстеда–Лоури,кислоты представляют собой вещества, способные отдавать протон (доноры протона), а основания – вещества, присоединяющие протон (акцепторы протона). Такой подход известен как протонная теория кислот и оснований (протолитическая теория). В общем виде кислотно-основноевзаимодействие описывается уравнением:
кислота основание сопряженное сопряженная основание кислота
По Льюису, кислотные и основные свойства органических соединений оцениваются по способности принимать или предоставлять электронную пару с последующим образованием связи. Атом, принимающий электронную пару, является акцептором электронов, а соединение, содержащее такой атом, следует отнести к кислотам. Атом, предоставляющий электронную пару, является донором электронов, а соединение, содержащее такой атом, – основанием. Кислоты Льюиса – акцепторы пары электронов; основания Льюиса – доноры пары электронов.
13. Электронная теория Льюиса. «Жесткие» и «мягкие» кислоты и основания. Кислота – частица с незаполненной внешней электронной оболочкой, способная принимать пару электронов (кислота = акцептор электронов). Основание – частицы со свободной парой электронов, которую можно отдать для образования химической связи (основание = донор электронов). К кислотам по Льюису относятся:молекулы, образованные атомами с незаполненной восьмиэлектронной оболочкой (BF3,SO3); катионы-комплексообразователи (Fe3+,Co2+,Ag+, др.);галогениды с ненасыщенными связями (TiCl4,SnCl4);молекулы с поляризованными двойными связями (CO2,SO2) и др. К основаниям по Льюису относят:молекулы, содержащие свободные электронные пары (NH3,H2O);анионы (Сl–,F–);органические соединения с двойными и тройными связями (ацетон СН3СОСН3);ароматические соединения (анилин С6Н5NH2, фенол С6Н5ОН). ПротонH+ в теории Льюиса является кислотой, (акцептор электронов), гидроксид ионOH– – основание (донор электронов): НО–(↑↓) + Н+ ↔ НО(↑↓)Н. Взаимодействие между кислотой и основанием заключается в образовании химической донорно-акцепторной связи между реагирующими частицами.Реакция между кислотой и основанием в общем виде: B(↑↓)основание +Aкислота↔D(↑↓)A. Кислоты и основания Льюиса. Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи. Кислоты Льюиса – акцепторы пары электронов, основания Льюиса – доноры пары электронов. Кислотами Льюиса могут быть молекулы, атомы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. К кислотам Льюиса относятся галогениды элементов II и III групп периодической системы, галогениды других металлов, имеющих вакантные орбитали, протон. Кислоты Льюиса в реакциях участвуют в качестве электрофильных реагентов. Основаниями Льюиса являются молекулы, атомы или анионы, имеющие неподеленную пару электронов, которую они предоставляют для образования связи с вакантной орбиталью. К основаниям Льюиса относятся спирты, простые эфиры, амины, тиоспирты, тиоэфиры, а также соединения, имеющие p-связи. В реакциях основания Льюиса проявляют себя как нуклеофильные частицы. Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО или принцип Пирсона). Согласно принципа Пирсона, кислоты и основания подразделяются на жесткие и мягкие. Жесткие кислоты – это кислоты Льюиса, донорные атомы которых малы по размеру, обладают большим положительным зарядом, большой электроотрицательностью и низкой поляризуемостью. К ним относятся: протон, ионы металлов (К+, Na+, Mg2+, Ca2+, Al3+), AlCl3 и др. Мягкие кислоты - – это кислоты Льюиса, донорные атомы которых имеют большие размеры, большую поляризуемость, обладают малым положительным зарядом и низкой электроотрицательностью. К ним относятся: ионы металлов (Ag+, Cu+), галогены (Br2, I2), катионы Br+, I+ и др. Жесткие основания – основания Льюиса, донорные атомы которых обладают высокой электроотрицательностью, низкой поляризуемостью, имеют малый радиус атома. К ним относятся: Н2О, ОН-, F-, Cl-, NO3-, ROH, NH3, RCOO- и др. Мягкие основания -основания Льюиса, донорные атомы которых обладают высокой поляризуемостью, низкой электроотрицательностью, имеют большой радиус атома. К ним относятся: Н-, I-, C2H4, C6H6, RS- и др. Суть принципа ЖМКО состоит в том, что жесткие кислоты реагируют с жесткими основаниями, мягкие кислоты – с мягкими основаниями
14. Состав, строение и виды изомерии у этиленовых углеводородов. Физические свойства. Реакции полимеризации; механизмы реакции полимеризации. Окисление кислородсодержащими окислителями и биологическое окисление.
Состав, строение и виды изомерии у этиленовых углеводородов Алкены, или олефины, этиленовые — непредельные углеводороды, в молекулах которых между углеродными атомами имеется одна двойная связь. (Слайд 3) Алкены содержат в своей молекуле меньшее число водородных атомов, чем соответствующие им алканы (с тем же числом углеродных атомов), поэтому такие углеводороды называют непредельными или ненасыщенными. Алкены образуют гомологический ряд с общей формулой CnH2n. Простейшим представителем этиленовых углеводородов, его родоначальником является этилен (этен) С2Н4. Строение его молекулы можно выразить такими формулами: H H H H | |:: C==C C::C | |:: H H H H По названию первого представителя этого ряда такие углеводороды называют этиленовыми. В алкенах атомы углерода находятся во втором валентном состоянии (sр2-гибридизация). (Слайд 4) В этом случае между углеродными атомами возникает двойная связь, состоящая из одной s- и одной p-связи. Длина и энергия двойной связи равны соответственно 0,134 нм и 610 кДж/моль.Все валентные углы НСН близки к 120º. Для алкенов характерны два вида изомерии: структурная и пространственная. (Слайд 5) Виды структурной изомерии: · изомерия углеродного скелета , · изомерия положения двойной связи , · межклассовая изомерия . Геометрическая изомерия — один из видов пространственной изомерии. Изомеры, у которых одинаковые заместители (при разных углеродных атомах) расположены по одну сторону от двойной связи, называют цис-изомерами, а по разную — транс-изомерами: . Физические свойства Реакции полимеризации; механизмы реакции полимеризации. Одной из наиболее важных в практическом отношении реакций непредельных соединений (или олефинов) является полимеризация. Реакцией полимеризации называется процесс образования высокомолекулярного соединения (полимера) путем соединения друг с другом молекул исходного низкомолекулярного соединения (мономера). При полимеризации двойные связи в молекулах исходного непредельного соединения "раскрываются", и за счет образующихся свободных валентностей эти молекулы соединяются друг с другом. В зависимости от механизма реакции полимеризация бывает двух видов:
“Радикальная полимеризация вызывается (инициируется) веществами, способными в условиях проведения реакции распадаться на свободные радикалы - например, пероксидами, а также действием тепла и света. CH2=CH2 ––R ˙ ® R–CH2−CH2• ––C2H4® R−CH2−CH2−CH2−CH2• На начальной стадии радикал-инициатор атакует молекулу этилена, вызывая при этом гомолитическое расщепление двойной связи, присоединяется к одному из атомов углерода и образует новый радикал. Образующийся радикал атакует далее следующую молекулу этилена и по указанному пути приводит к новому радикалу, вызывающему дальнейшие аналогичные превращения исходного соединения.
Ионная или каталитическая полимеризация
Ионная полимеризация (катионная)
CH2=CH2 ––H+® CH3−CH2+ ––C2H4® CH3−CH2−CH2−C+H2 и т.д.
Ионная полимеризация (анионная)
CH2=CH2 ––R–M® [R−CH2−CH2]-M+ ––C2H4® [R−CH2−CH2−CH2−CH2]-M+ и т.д.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 4937; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.106 (0.01 с.) |