Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Дикарбоновые предельные кислоты (щавелевая, малоновая, янтарная). Ненасыщенные карбоновые кислоты (акриловая, малеиновая, фумаровая).Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Предельные дикарбоновые кислоты (двухосновные насыщенные карбоновые кислоты) – карбоновые кислоты, в которых насыщенный углеводородный радикал соединен с двумя карбоксильными группами –COOH. Все они имеют общую формулу HOOC(CH2)nCOOH, где n = 0, 1, 2, … Номенклатура Систематические названия двухосновных предельных карбоновых кислот даются по названию соответствующего алкана с добавлением суффикса -диовая и слова кислота. Изомерия Изомерия скелета в углеводородном радикале проявляется, начиная с бутандиовой кислоты, которая имеет два изомера: HOOC–CH2–CH2–COOH н-бутандиовая кислота (этан-1,2-дикарбоновая кислота); СН3–CH(COOH)–COOH этан-1,1-дикарбоновая кислота.
(пропандиовая, метандикарбоновая кислота). Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и сложные эфиры малоновой кислоты называются малонатами. Малонат кальция содержится в соке сахарной свёклы.
Ненасыщенные карбоновые кислоты содержат в углеводородной цепи одну или несколько двойных или тройных связей. Полимеризацией сложных эфиров и нитрилов этих кислот получают пластмассы, пленкообразующие и связующие вещества. Ненасыщенные карбоновые кислоты вступают в реакции, характерные для карбоксильной группы и для двойных связей. Как карбоновые кислоты они образуют сложные эфиры и другие производные. В живом мире они в основном встречаются в виде сложных эфиров глицерина (триацилглицерины), т.е. в виде жидких масел. АКРИЛОВАЯКИСЛОТА (пропеновая к-та, этиленкарбоновая к-та) СН2=СНСООН, мол. м. 72,06; бесцв. жидкость с резким запахом; Акриловая кислота обладает химическими свойствами, присущими карбоновым кислотам: образует соли, хлорангидриды, ангидриды, сложные эфиры. амиды и пр. Она также вступает в реакции присоединения, характерные для этиленовых углеводородов. При действии амальгамы Na в водном растворе и гидрировании в жидкой фазе в присутствии Ni, Pt, Pd акриловая кислота превращается в пропионовую кислоту, в среде ДМСО гидродимеризуется. Присоединение протонных кислот, воды и NH3 происходит против правила Марковникова с образованием
Малеиновая кислота — органическое соединение с формулой HOOC-CH=CH-COOH. Название по номенклатуре — цис-бутендиовая кислота. Её транс-изомером является фумаровая кислота. Наиболее часто она используется для получения фумаровой кислоты.
31.Гидрокси- и аминокислоты. Реакции циклизации α-гидрокси- и α-аминокислот; образование лактидов и дикетопиперазинов. β-гидрокси-, и β-аминокислоты, реакции элиминирования. ГИДРОКСИКИСЛОТЫ (Г/К) Функц. группы Г/К: ОН и СООН (старшая) Классификация 1) по у/в скелету: алифат-кие; аромат-кие, циклические 2) по количеству СООН –групп: моно-, ди- или три карбоновые к-ты; 3) по количества ОН-групп: ди-, три-, тетра и т. д. гидроксикислоты. По взаимному расположению функциональных групп различают α-, β-, γ-, δ-гидроксикислоты и т. д..Специфические свойства гидроксикислот обусловлены принадлежностью этих соединений одновременно к спиртам и карбоновым кислотам и во многом зависят от взаимного расположения АМИНОКИСЛОТЫ, органические к-ты, содержащие одну или несколько аминогрупп. В зависимости от природы кислотной ф-ции аминокислоты подразделяют на аминокарбоновые, например, аминосульфоновые, например, аминофосфоновые, например, и аминоарсиновые, например. Согласно правилам ИЮПАК, название аминокислоты производят от названия соответствующей к-ты; взаимное расположение в углеродной цепи карбоксильной и аминной групп обозначают обычно цифрами, в нек-рых случаях - греч. буквами. Однако, как правило, пользуются тривиальными названиями аминокислот.Структура и физические свойства. По физ. и ряду хим. свойств аминокислоты резко отличаются от соответствующих к-т и оснований. Они лучше раств. в воде, чем в орг. р-рителях; хорошо кристаллизуются; имеют высокую плотность и исключительно высокие т-ры плавления (часто разложения). Эти св-ва указывают на взаимод. аминных и кислотных групп, вследствие чего аминокислоты в твердом состоянии и в р-ре (в широком интервале рН) находятся в цвиттер-ионной форме. функциональных групп. При нагревании a-аминокислот в результате межмолекулярной дегидратации образуются циклические амиды - дикетопиперазины:
При близком расположении функциональных групп реакция дегидратации проходит межмолекулярно, при этом α-гидроксикислоты образуют циклические сложные эфиры — лактиды: β -Гидрокси- и β -аминокислоты. Характерное общее свойство этих гетерофункциональных кислот заключается в способности к элиминированию молекулы воды или соответственно аммиака с образованием α,β-ненасыщенных кислот.
Реакции элиминирования протекают в мягких условиях. Это объясняется высокой протонной подвижностью α-атома водорода, обусловленной электронным влиянием двух электроноакцепторных групп (Х и СООН).
32.γ-гидрокси- и γ-аминокислоты. Реакции циклизации. Лактоны, лактамы. Лактим-лактамная таутомерия. γ -Гидрокси- и γ -аминокислоты. Эти кислоты, как и кислоты с δ-расположением функциональных групп, при нагревании претерпевают внутримолекулярную циклизацию. Из гидроксикислот при этом образуются циклические сложные эфиры - лактоны, из аминокислот - циклические амиды - лактамы. Лактоны легко образуются уже при незначительном нагревании, а также в кислой среде.
Принципиально так же происходит внутримолекулярное взаимодействие амино- и карбоксильной групп в γ- и δ-аминокислотах.
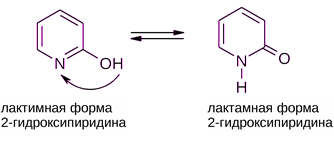
Лактоны и лактамы, будучи соответственно сложными эфирами и амидами, гидролизуются в кислой или щелочной среде. ЛАКТИМ-ЛАКТАМНАЯ ТАУТОМЕРИЯ Этот вид таутомерии характерен для азотсодержащих гетероциклов с фрагментом N=C—ОН. Взаимопревращение таутомерных форм связано с переносом протона от гидроксильной группы, напоминающей фенольную ОН-группу, к основному центру — пиридиновому атому азота и наоборот. Обычно лактамная форма в равновесии преобладает.
33.Двухосновные (яблочная, винные), трехосновные (лимонная) гидроксикислоты. Доказательство наличия 2-х карбоксильных групп в винной кислоте. Образование лимонной кислоты в результате альдольного присоединения. Разложение лимонной кислоты по типу α-гидроксикарбоновых кислот.
Образование калиевых солей, обладающих различными физическими свойствами, является доказательством наличия двух карбоксильных групп в винной кислоте.
34.Понятие о кетокислотах на примере ацетоуксусной кислоты. Ацетоуксусный эфир, кето-енольная таутомерия. Кетонное расщепление ацетоуксусного эфира.
Для ацетоуксусной кислоты характерна кето-енольная таутомерия. В результате индуктивного эффекта кетогруппы ацетоуксусная кислота является более «кислой», чем её основа - масляная кислота.
Ацетоуксусная кислота реагирует с галогенами (хлором или бромом), которые разлагают её до соответствующего галогеноводорода, углекислого газа и галоидацетона (хлор- или бромацетона):
Реакции кетонного расщепления ацетоуксусного эфира
|
|||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 8710; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.31.64 (0.012 с.) |

 Щаве́левая кислота (этандиовая кислота). Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KMnO4).
Щаве́левая кислота (этандиовая кислота). Принадлежит к сильным органическим кислотам. Обладает всеми химическими свойствами, характерными для карбоновых кислот. Соли и эфиры щавелевой кислоты называются оксалатами. В природе содержится в щавеле, ревене, карамболе и некоторых других растениях в свободном виде и в виде оксалатов калия и кальция. Щавелевая кислота (или оксалат-ион C2O42−) является восстановителем (обесцвечивает раствор KMnO4). Мало́новая кислота
Мало́новая кислота Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота).Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида.
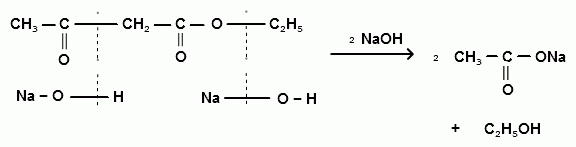
Янтарная кислота (бутандиовая кислота, этан-1,2-дикарбоновая кислота).Бесцветные кристаллы, растворимые в воде и спирте. Содержится в небольших количествах во многих растениях, янтаре. Стимулирует рост и повышает урожай растений, ускоряет развитие кукурузы. В промышленности янтарную кислоту получают главным образом гидрированием малеинового ангидрида. замещенных производных.
замещенных производных.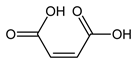
 Фумаровая кислота — химическое соединение с формулой HO2CCH=CHCO2H. Кристаллы имеют фруктовый вкус. Соли и эфиры называют фумаратами. Фумаровая кислота (пищевая добавка Е297) – бесцветные или белые кристаллы, не обладающие запахом, характеризующиеся острым кислым фруктовым вкусом. В пищевой промышленности используется в качестве регулятора кислотности и имеет маркировку Е297. Фумаровая кислота плохо растворима в воде.
Фумаровая кислота — химическое соединение с формулой HO2CCH=CHCO2H. Кристаллы имеют фруктовый вкус. Соли и эфиры называют фумаратами. Фумаровая кислота (пищевая добавка Е297) – бесцветные или белые кристаллы, не обладающие запахом, характеризующиеся острым кислым фруктовым вкусом. В пищевой промышленности используется в качестве регулятора кислотности и имеет маркировку Е297. Фумаровая кислота плохо растворима в воде.





 яблочная кислота (оксиянтарная кислота, гидроксибутандиовая кислота) НООС-СН(ОН)-СН2-СООН — двухосновная оксикарбоновая кислота. Бесцветные гигроскопичные кристаллы, хорошо растворимые в воде и этиловом спирте.
яблочная кислота (оксиянтарная кислота, гидроксибутандиовая кислота) НООС-СН(ОН)-СН2-СООН — двухосновная оксикарбоновая кислота. Бесцветные гигроскопичные кристаллы, хорошо растворимые в воде и этиловом спирте.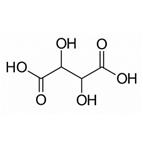 Винная кислота является органическим соединением – двухосновной оксикислотой.В естественном виде винная кислота встречается в винограде Винная кислота (иначе – диоксиянтарная или тартаровая кислота) представляет собой кристаллы без запаха и цвета, которые имеют очень кислый вкус. Как пищевая добавка винная кислота имеет название Е334. Винная кислота в естественном виде встречается во многих фруктах. Особенно ее много в винограде и цитрусовых. В некоторых продуктах она сочетается с магнием, кальцием или калием. Первоначально винную кислоту получали как побочный продукт винодельческой промышленности. Она в основном использовалась для предотвращения роста бактерий в вине в чанах и бочках.
Винная кислота является органическим соединением – двухосновной оксикислотой.В естественном виде винная кислота встречается в винограде Винная кислота (иначе – диоксиянтарная или тартаровая кислота) представляет собой кристаллы без запаха и цвета, которые имеют очень кислый вкус. Как пищевая добавка винная кислота имеет название Е334. Винная кислота в естественном виде встречается во многих фруктах. Особенно ее много в винограде и цитрусовых. В некоторых продуктах она сочетается с магнием, кальцием или калием. Первоначально винную кислоту получали как побочный продукт винодельческой промышленности. Она в основном использовалась для предотвращения роста бактерий в вине в чанах и бочках.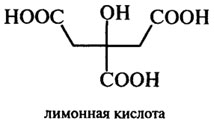 Лимонная кислота— одноводный кристаллогидрат. Хорошо растворима в воде: 133 грамма в 100 граммах воды при 20°С. Также растворяется в спирте, диэтиловом эфире. При нагревании до 175°С лимонная кислота переходит в аконитовую (А) и ацетондикарбоновую (Б) кислоты, выше 175°С образует итаконовую кислоту.
Лимонная кислота— одноводный кристаллогидрат. Хорошо растворима в воде: 133 грамма в 100 граммах воды при 20°С. Также растворяется в спирте, диэтиловом эфире. При нагревании до 175°С лимонная кислота переходит в аконитовую (А) и ацетондикарбоновую (Б) кислоты, выше 175°С образует итаконовую кислоту.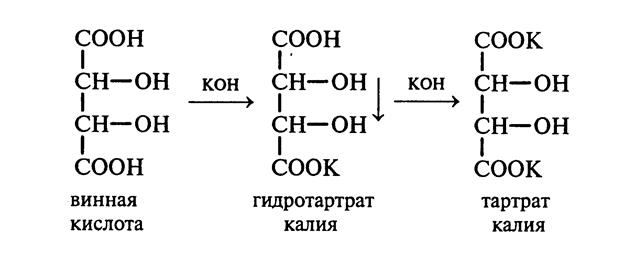


 Ацетоуксусная кислота (формула СН3·CO·СН2СООН) — органическая кетокислота; промежуточный продукт обмена жирных кислот и аминокислот. Ацетоуксусная кислота — органическое соединение из группы β-кетокислот.
Ацетоуксусная кислота (формула СН3·CO·СН2СООН) — органическая кетокислота; промежуточный продукт обмена жирных кислот и аминокислот. Ацетоуксусная кислота — органическое соединение из группы β-кетокислот.