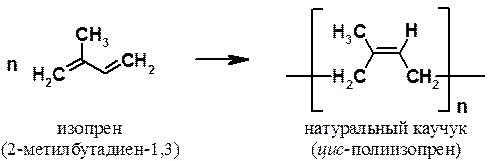Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Свойства сопряженных алкадиеновСодержание книги
Поиск на нашем сайте
Наибольшее практическое значение имеют дивинил или бутадиен-1,3 (легко сжижающийся газ, т.кип = – 4,5°) и изопрен или По химическим свойствам диеновые углеводороды подобны алкенам. Они легко окисляются и вступают в реакции присоединения. Однако сопряженные диены отличаются некоторыми особенностями, которые обусловлены делокализацией (рассредоточением) p -электронов. Молекула бутадиена-1,3 СН2=СН-СН=СН2 содержит четыре атома углерода в sp2-гибридизованном состоянии и имеет плоское строение.
p-Электроны двойных связей образуют единое p -электронное облако (сопряженную систему) и делокализованы между всеми атомами углерода.
Порядок связей (число общих электронных пар) между атомами углерода имеет промежуточное значение между 1 и 2, т.е. нет чисто одинарной и чисто двойных связей. Строение бутадиена более точно отражает формула с делокализованными связями.
Аналогично построены молекулы изопрена:
Образование единого p -электронного облака, охватывающего 4 атома углерода: приводит к возможности присоединения реагента по концам этой системы, т.е. к атомам С1 и С4. Поэтому дивинил и изопрен наряду с присоединением 1 моля реагента по одной из двойных связей (1,2- или 3,4-) вступают в реакции 1,4-присоединения. Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции (с повышением температуры обычно увеличивается вероятность 1,4-присоединения).
Галогенирование 1,4-присоединение:
1,2-присоединение:
Сопряженные диены играют очень важную роль при получении высокомолекулярных соединений, поскольку из 2-метилбутадиеновых (изопреновых) звеньев построены молекулы натурального каучука.
17.Биологическая роль непредельных соединений. Липиды – органические жироподобные соединения, не растворимые в воде, но хорошо растворимые в неполярных растворителях (эфире, бензине, бензоле, хлороформе). Они обнаружены в клетках всех живых организмов. Содержание липидов в разных клетках сильно варьирует: от 2-3 до 50-90% (в клетках семян растений и жировой ткани животных). В химическом отношении большинство липидов – это сложные эфиры высших карбоновых кислот и ряда спиртов. В природе наиболее распространены липиды следующих классов: нейтральные жиры, воски, фосфолипиды, стеролы. Нейтральные жиры (триацилглицеролы). Каждая молекула жира образована молекулой трехатомного спирта глицерола и тремя карбоновыми кислотами, каждая из которых содержит четное число атомов углерода. Атомы углерода в молекулах высших карбоновых кислот могут быть соединены друг с другом у предельных (насыщенных) кислот простыми, у непредельных (ненасыщенных) кислот - двойными связями. Среди предельных высших карбоновых кислот наиболее часто в состав жиров входят пальмитиновая, стеариновая и арахиновая; среди непредельных: олеиновая, линолевая, линоленовая. Степень насыщенности и длина цепей высших карбоновых кислот (т.е. число атомов углерода) определяют физические свойства того или иного жира. У жиров с короткими и непредельными цепями низкая температура плавления: при комнатной температуре они имеют жидкую (масла) либо мазеподобную (жиры) консистенцию. Жиры с длинными и насыщенными цепями высших карбоновых кислот при комнатной температуре – твердые вещества. Воски – сложные эфиры одноатомных (с одной спиртовой группой) высокомолекулярных (имеющих длинный углеродный скелет) спиртов и высших карбоновых кислот. У животных воски входят в состав липидных фракций мозга, лимфатических узлов, селезенки, желчных путей. Воски секретируются кожными железами: покрывая кожу и ее производные (волосы, шерсть, перья) воски смягчают их и предохраняют от действия воды. Пчелы производят воск и используют его в строительстве сот. У растений воска образуются в клетках эпидермиса и покрывают листья растений (хвойные, капуста), плоды, защищая от избыточного испарения воды. Восковой налет хорошо заметен на стеблях и листьях ржи, листьях капусты, ириса и других растений. Он легко стирается. У тропических растений слой воска на листьях может достигать толщины в несколько миллиметров. Фосфолипиды – липиды, у которых одна из крайних цепей высших карбоновых кислот замещена на фосфатную группу, к которой могут присоединяться другие молекулы. Это амфифильные соединения, имеющие полярные гидрофильные головки и неполярные гидрофобные хвосты. Такая двойственная природа фосфолипидов обусловливает их ключевую роль в образовании биологических мембран. К фосфолипидам относятся и сфинголипиды, молекулы которых построены на основе спирта сфингозина; они тоже содержат фосфатную группу. Стеролы – наиболее распространенная в природе группа стероидов – веществ, построенных на основе спирта холестерола. Они очень плохо растворимы в воде и не содержат высших карбоновых кислот. Это желчные кислоты, холестерол, половые гормоны, витамин D и др. К стеролам близки терпены (гиббереллины – ростовые вещества растений; фитол – входит в состав хлорофилла; каратиноиды, ментол, камфора – эфирные масла растений). Функции липидов: 1) строительная: а) образуют бимолекулярный слой биологических мембран (фосфолипиды, стеролы, гликолипиды); б) липиды участвуют в образовании миелиновых оболочек нервных волокон, где выполняют функции изолятора при передаче нервных импульсов; 2) энергетическая: а) при окислении 1 г жира высвобождается 38,9 кДж; б) в форме липидов хранится значительная часть энергетических запасов организма (половина потребляемой клетками энергии в состоянии покоя, образуется за счет окисления жиров; высокое содержание липидов в семенах обеспечивает энергией развитие зародыша и проростка); 3) источник метаболической воды: при окислении 100 г жира образуется примерно 105 г воды, которая используется организмами (жир, запасенный в горбу верблюда, позволяет ему обходиться в пустыне без воды 10-12 суток; животные в спячке); 4) защита и теплоизоляция: накопление жира а) в подкожной жировой клетчатке (у тюленей и китов до 1 м) выполняют теплоизоляционную функцию; б) вокруг некоторых органов (почка, кишечник), обеспечивает защиту как организма, так и отдельных органов от механических повреждений; 5) смазывающая и водоотталкивающая (см. воски); 6) регуляторная: липоиды служат предшественниками некоторых гормонов (тестостерона, прогестерона, кортизола, альдостерона), витамин Д и желчных кислот, следовательно, участвуют в регуляции обменных процессов.
36 Критерии самопроизвольного протекания поверхностных явлений К поверхностным явлениям, связанным с уменьшением общей поверхности, относят: 1) капиллярные явления. в частности приобретение каплями и газовыми пузырьками сферич. формы, при которой поверхность капли минимальна. 2) Спекание мелких твердых частиц в порошках при достаточно высоких температурах. 3) Собирательная рекристаллизация - укрупнение зерен поликристаллического материала при повышении температуры. 4) Изотермическая перегонка - увеличение объема крупных капель за счет уменьшения мелких. При этом вследствие повышенного давления паров жидкости с более высокой кривизной поверхности происходит испарение мелких капель и последующая их конденсация на более крупных каплях. Для жидкости, находящейся на твердой подложке, существенная роль в переносе вещества от мелких капель к крупным играет поверхностная диффузия. Изотермическая перегонка твердых частиц может происходить через жидкую фазу вследствие повышенной растворимости более мелких частиц Коалесценция - слияние капель жидкости или пузырьков газа. Коагуляция - слипание частиц в дисперсных системах. Сорбция - это процессы поглощения газов или растворенных веществ твердыми материалами или жидкостями.
Вещество, на поверхности которого идет адсорбция, называется адсорбентом, а которое адсорбируется -адсорбатом (адсорбтивом). Адсорбцию Г обычно выражают соотношением количества адсорбата X, приходящегося на единицу площади адсорбента S (кмоль/м2) Г = X/S Если адсорбентом является твердое пористое тело, общую поверхность которого определить невозможно, то величину адсорбции Г относят к единице массы адсорбента m(кмоль/кг) Г = X/m Между адсорбентом и адсорбатом возникают адсорбционные силы. В зависимости от их природы рассматривают два крайних случая: физическую ихимическую адсорбцию.
Физическая адсорбция возникает за счет Ван-дер-Ваальсовых взаимодействий. Она характеризуется 1) Обратимостью, т.е. может протекать обратный процесс - десорбция. Скорость адсорбции с течением времени уменьшается, а скорость десорбции увеличивается, что приводит к адсорбционному равновесию адсорбция ↔ десорбция при котором скорости двух противоположных процессов становятся одинаковыми.
2)При повышении температуры величина адсорбции уменьшается, так как увеличивается скорость десорбции. 3)Малой специфичностью. 4)При физической адсорбции могут быть как нелокализованная адсорбция, когда молекулы адсорбата способны передвигаться по поверхности адсорбента, так и локализованная адсорбция.
Химическая адсорбция является химическим процессом, поэтому -Необратима. -С повышением температуры увеличивается. -Специфична. Адсорбция происходит, если возможна химическая реакция. Молекулы адсорбата связаны с адсорбентом прочными химическими силами и не могут перемещаться по поверхности последнего, поэтому химическая адсорбция - локализованная. Примером является адсорбция кислорода на алюминии, приводящая к образованию поверхностной оксидной пленки. Уравнение адсорбции устанавливает функциональную связь величины адсорбции с равновесной концентрацией и температурой Г = f(С, Т), если адсорбция идет из растворов, и равновесным давлением и температурой Г =f(Р, Т) если адсорбируется газ. При постоянной температуре адсорбированное количество вещества есть функция равновесной концентрации Г = f(С) тили равновесного давления Г =f(Р)т. Графическая зависимость называется изотермой адсорбции и имеет вид кривой, на которой можно выделить три участка: IиIII - прямолинейные, II - криволинейный.
2) Зако́н Ге́нри — закон, по которому при постоянной температуре растворимость газа в данной жидкости прямо пропорциональна давлению этого газа над раствором. Закон пригоден лишь для идеальных растворов и невысоких давлений. C = kp где: p — парциальное давление газа над раствором, Па c — молярная концентрация газа в растворе, моль/л k — коэффициент (константа) Генри, моль/(Па*л). Коэффициент зависит от природы газа и растворителя, а также от температуры.
3) Закон Сеченова- закон, описывающий количественно снижение растворимости газов в присутствии электролитов. Одной из причин уменьшения растворимости газа в присутствии электролита явл. гидратация ионов электролитов молекулами растворителя, в результе умень-тся число свобод молекул расторителя, т.е. его растворяющая способность. Формула: с(Х)+Со(Х)е в степени –КсСэ, где С(Х)-растворимость газа Х в чистом растворителе, Сэ-концентрация электролита, Кс-константа Сеченова, кот зависти от природы газа, электорлита и температуры.
|
||||
|
Последнее изменение этой страницы: 2016-04-07; просмотров: 602; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.155.149 (0.009 с.) |